
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
分析 (1)已知①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由盖斯定律可知①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),以此计算△H;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢;
(2)①C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,保证电子守恒时总反应减去正极反应得到负极反应;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应;
C、阳极应该用铁电极,Fe失去电子;
D、阴极氢离子放电生成H2;
(3)①实验1中CO的转化率为$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{0.4mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动;②H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.4mol/L 0.4mol/L 0.4mol/L 0.4mol/L
平衡 0.6mol/L 1.6mol/L 0.4mol/L 0.4mol/L
结合平衡浓度计算K;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动.
解答 解:(1)已知①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由盖斯定律可知①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生氧化反应,电极反应式为:C3H8+26OH--20e-=3CO32-+17H2O,
故答案为:C3H8+26OH--20e-=3CO32-+17H2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B,、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C,、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D,、阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故选:ABD;
(3)①实验1中CO的转化率为$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{0.4mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放;
②H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.4mol/L 0.4mol/L 0.4mol/L 0.4mol/L
平衡 0.6mol/L 1.6mol/L 0.4mol/L 0.4mol/L
则K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$,
故答案为:$\frac{1}{6}$;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强.
点评 本题考查化学平衡的计算,为高频考点,把握平衡移动影响因素、平衡常数计算、盖斯定律应用、电极反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件使平衡向正反应方向移动,反应物的转化率一定增大 | |
| B. | 浓度变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| C. | 温度或压强的变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| D. | 催化剂可使化学反应速率加快,使反应物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
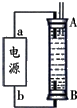
 分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )| A. | 稍过量的氢氧化钠是确保盐酸完全反应 | |
| B. | 仪器A的名称是环形玻璃搅拌棒 | |
| C. | 在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度 | |
| D. | 用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管未用标准酸液或标准碱液润洗 | |
| B. | 锥形瓶用待测液润洗后加入待测液 | |
| C. | 滴定管在滴定前未进行赶气 | |
| D. | 读数时视线要平视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3、H2SO4、H2SO3 | B. | SO2、H2SO3、H2SO4 | C. | SO3、H2SO3、H2SO4 | D. | SO2、H2SO4、H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com