
| A. | Na+、K+、MnO4-、Cl- | B. | Cl-、SO32-、K+、Na+ | ||
| C. | Na+、Cl-、CH3COO-、K+ | D. | K+、I-、Na+、ClO- |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液中存在大量氢离子,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.亚硫酸根离子与氢离子反应,该反应不属于氧化还原反应;
C.醋酸根离子与氢离子反应生成醋酸,该反应不是氧化还原反应;
D.四种离子都是无色离子,次氯酸根离子与碘离子发生氧化还原反应而不能共存.
解答 解:溶液无色可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=0的溶液为酸性溶液,溶液中存在大量氢离子,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.SO32-与强酸性溶液中的氢离子反应,但该反应不属于氧化还原反应,故B错误;
C.CH3COO-与氢离子反应生成弱电解质醋酸,但该反应不是氧化还原反应,故C错误;
D.K+、I-、Na+、ClO-都是无色离子,由于I-、ClO-之间发生氧化还原反应而不能大量共存,符合条件,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 冶炼单质Al、Fe、Cu均可采用热还原的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各种水果之所以有果香味,是因为水果中含有一定的酯类物质 | |
| B. | 苯酚有毒,所以日常所用的药皂中不可能掺入苯酚 | |
| C. | 用浓溴水可以除去苯中少量的苯酚 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有2个A原子 | B. | 有2个氧原子 | C. | 有1个A原子 | D. | 有1个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | 只有② | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 | |
| B. | 浓FeCl3溶液滴入沸水加热形成红褐色透明液体 | |
| C. | 自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) | |
| D. | 加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2 | B. | CH2=CH2 | C. | CH≡CH | D. | CH≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
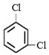
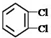 ;③35Cl、37Cl;
;③35Cl、37Cl;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com