
| A. | 该反应是置换反应 | B. | FeCl3是氧化剂 | ||
| C. | Cu是还原剂,被腐蚀 | D. | 该反应属于离子反应 |
分析 A.该反应产物中没有单质生成,不属于置换反应;
B.氧化剂在反应中得到电子,化合价降低;
C.铜在反应中化合价升高被氧化,作还原剂;
D.该反应又离子参加,属于离子反应.
解答 解:A.该反应的反应物中没有单质,不属于置换反应,故A错误;
B.氯化铁在反应中得到电子,化合价降低被还原,作氧化剂,故B正确;
C.Cu在反应中化合价升高被氧化,作还原剂,故C正确;
D.该反应中有铁离子、铁离子和亚铁离子参与,属于离子反应,故D正确;
故选A.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握氧化剂、还原剂的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 遇到石蕊试液变红的溶液:Na+、NH4+、K+、NO3- | |
| B. | 遇[Fe(CN)6]3-产生蓝色沉淀的溶液:Ca 2+、Cl-、ClO-、Fe3+ | |
| C. | 水电离出的c(OH-)=1×10-12 mol/L的溶液:S2O3-、Cl-、NO3-、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:Ba 2+、HCO3-、I-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 平衡常数K | 甲的物质的量 | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
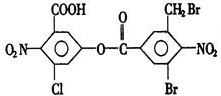
| A. | 5mol | B. | 6mol | C. | 7mol | D. | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 二氧化锰 | D. | 硫酸铜 氢氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
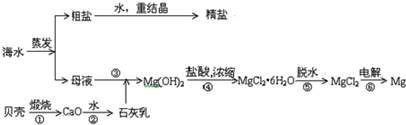
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,导致实验结果偏高 | |
| B. | 某溶液中滴加HNO3无明显现象,再滴加Ba(NO3)2溶液出现白色沉淀,说明原溶液中含有SO42- | |
| C. | 制备乙酸乙酯的实验中,用饱和食盐水除杂 | |
| D. | 在蒸发皿中加热蒸干AlCl3可以得到该物质的固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com