
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?),t1时刻达到平衡,t2时刻缩小容器体积,t3时刻再次达到平衡后未再改变条件,如图所示。下列说法正确的是
X(g)+Y(?),t1时刻达到平衡,t2时刻缩小容器体积,t3时刻再次达到平衡后未再改变条件,如图所示。下列说法正确的是

A. Z和W在该条件下至少有一种为气态
B. t1~ t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~ t2时间段与t3时刻后的X浓度不相等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而增大
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO![]() +4H2O
+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是
A. 将40 g NaOH溶解于1 L水中
B. 将0.25 mol NaOH溶于水配成250 mL溶液
C. 将1 L10 mol/L的浓盐酸与9 L水混合
D. 将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) ![]() x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
A. 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B. 平衡时,甲、乙两容器中A、B的物质的量之比相等
C. 平衡时,甲中A的体积分数为40%
D. 若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将金属钠置于空气中的加热,可以观察到有淡黄色固体生成,试写出该物质的电子式:_____________ ; 向反应后的固体中加入足量的水,书写反应方程式:____________ ;如金属钠中混有少量金属钾,如何鉴别钾元素的存在?试简述实验操作及对应现象 ______ ;
(2)某过氧化钠样品可能混有含有少量Na2CO3,现设计实验验证样品中过氧化钠的含量。

将Wg样品置于装置A中烧瓶内,逐渐加入稀硫酸至过量,缓缓通入氮气。测得装置b增重D g,装置c的作用是___________________________ ;如未使用装置B,则所测定结果会____(填偏高,偏低或无影响);试用所给数据计算过氧化钠的质量分数______;
(3)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:_____________________________________________________________。
(4)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置可以是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁、铜通过导线相连,置于稀硫酸中. 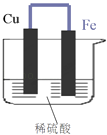
(1)铁片为极,其电极反应式 .
(2)铜片上的现象是 , 其发生的反应的类型是反应.(填“氧化”或“还原”)
(3)若导线中通过了0.6mol电子,Fe的质量理论上减少克.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( ) 
A.Y的非金属性比Z的弱
B.三种元素均为非金属元素
C.Z形成的气态氢化物比Y形成的气态氢化物稳定
D.Y元素的最高正化合价比Z元素的最高正化合价高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com