
| A. | 10mL0.1 mol•L-1的AlCl3溶液 | B. | 20mL0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30mL0.2 mol•L-1的KCl溶液 | D. | 100mL0.25 mol•L-1的NaCl溶液 |
分析 根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质分子中含有的离子的个数,与溶液的体积无关.
解答 解:A、10mL0.1 mol•L-1的AlCl3溶液所含Cl-物质的量浓度为0.1mol/L×3=0.3mol/L,故A正确;
B、20mL0.1 mol•L-1的CaCl2溶液中氯离子浓度为0.1mol/L×2=0.2mol/L,故B错误;
C、30mL0.2 mol•L-1的KCl溶液氯离子浓度为0.2mol/L×1=0.2mol/L,故C错误;
D、100mL0.25 mol•L-1的NaCl溶液氯离子浓度为0.25mol/L×1=0.25mol/L,故D错误;
故选A.
点评 本题考查物质的量浓度的计算,题目难度不大,注意离子浓度与溶质的浓度的关系即可解答,离子浓度与溶液体积无关.


科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、Ca2+、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| B. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-10的溶液中:Na+、NH4+、SO42-、NO3- | |
| C. | c(ClO-)=1.0mol•L-1的溶液中:Na+、SO32-、S2-、SO42- | |
| D. | 0.1 mol•L-1的NaAlO2溶液中:NH4+、Fe3+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体 | B. | 悬浊液 | C. | 溶液 | D. | 乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
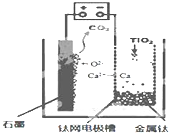 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )| A. | 由TiO2制得1mol 金属Ti,理论上外电路转移2NA电子 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 | |
| D. | 在制备金属钛前后,整套装置中CaO的总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com