
(15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:


(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2 + C6  CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2 + LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
(1)12 ; 90 ; (2)3 ,6,6,1,5,6 ;(3)1.50;
(4)SO42-、NH4+、Na+ 、F-; 洗涤、干燥 ;(5)0 ;7g
【解析】
试题分析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、 F- 离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+ 、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。
考点:考查物质制备条件的选择、化学方程式的配平、在溶液中离子浓度的关系、混合物分离的操作、锂离子电池的工作原理的知识。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:实验题
(12分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
②向新制的H2S饱和溶液中滴加新制的氯水 | (B)产生气体,可在空气中燃烧,溶液变为浅红色 |
③钠与滴有酚酞试液的冷水反应 | (C)反应不十分强烈,产生的气体可在空气中燃烧 |
④镁带与2mol/L盐酸反应 | (D)剧烈反应,产生可燃气体 |
⑤铝条与2mol/L盐酸反应 | (E)生成白色胶状沉淀,后来沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 | (F)生成淡黄色沉淀 |
(1) 实验目的: 研究同周期元素性质递变规律
(2) 实验用品:
仪器: ①________②________③________④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3) 实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4) 实验结论:
金属性: ________________ 非金属性: ________________
(5)写出⑥的总反应离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同 ②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物 ④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的庚烷所含的分子数为0.5 NA (NA为阿伏加德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
A.①和⑤ B.②和③ C.⑤和⑥ D.④和⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省6月高二化学期末测试卷(解析版) 题型:选择题
下列说法正确的是
A.糖类化合物都具有相同的官能团 B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇 D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,工作原理如图如示。下列有关说法正确的是
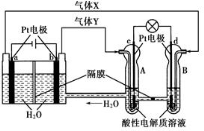
A.当有0.2 mol电子转移时,a电极产生2.24 L H2
B.b电极上发生的电极反应式为2H++2e-=H2↑
C.d电极上发生的电极反应式为O2+4H++4e-=2H2O
D.d电极上进行氧化反应,B池中的H+可以通过隔膜进入A池
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(15分)氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为______。氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化轨道类型为 。
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为____。
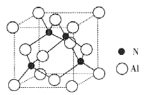
(3)X晶体中包含的化学键类型为______。(填字母标号)
A.离子键 B.共价键 C.配位键 D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是______
(5)若X的密度为pg/cm3,则晶体中最近的两个N原子的距离为______cm(阿伏加德罗常数用NA表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(18分)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
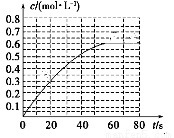
①298k时,该反应的平衡常数为________ L ·mol-1。
②下列事实能判断该反应处于平衡状态的是
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时
V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
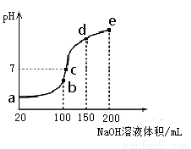
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常
数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序
是__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高二化学试卷(解析版) 题型:选择题
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关于普伐他汀的描述正确的是
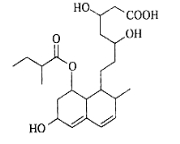
A.分子中含有3种官能团
B.可发生加成反应、氧化反应
C.在水溶液中羧基和羟基均能电离出H+
D.1 mol该物质最多可与l molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com