
分析 (1)根据元素守恒可判断有机化合物中一定含有C和H两种元素,根据生成17.6g的二氧化碳中C元素质量即为化合物中所含C元素质量、生成9.0g的水中H元素质量即为化合物中所含H元素质量,对氧元素的确定要根据二氧化碳和水中的氧元素质量之和与氧气中氧元素的质量来分析,若前者大,则有机化合物有氧元素,两者相等,则有机化合物没有有氧元素,然后求出各自的物质的量,计算该物质中各元素的原子个数比;根据碳、氢、氧的价键数判断能否据此确定该有机物的分子式;
(2)有机物A的分子式为C4H10O,可能为醚,也可能为醇,若为醚,根据可能的烃基进行组合判断同分异构体,若为醇,先书写丁基-C4H9异构,丁基异构数目等于丁醇的异构体数目;
(3)A能与金属钠反应放出气体,为醇,有机物A分子内有2种不同环境的氢原子,为两种氢原子,据此书写A的结构简式;
(4)醇在浓硫酸加热的条件下反应可以得到烯,烯烃可发生加聚反应;
(5)加成反应的原子利用率是100%,乙烯可以和氯化氢发生加成反应生成氯乙烷.
解答 解:(1)n(CO2)=$\frac{17.6g}{44g/mol}$=0.4 mol,n(H2O)=$\frac{9.0g}{18g/mol}$=0.5 mol,反应中消耗O2的物质的量n(O2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,
则有机物中氧原子物质的量 n(O)=0.4 mol×2+0.5 mol×1-0.6mol×2=0.1mol,所以该物质中C、H、O原子的个数比为0.4 mol:(0.5mol×2):0.1mol=4:10:1最简式为C4H10O,碳为四价,氢为1价,氧为二价,氢的最大饱和键数为2n+2(n为碳数),C4H10O中氢数已经饱和,所以能否据此确定该有机物的分子式为C4H10O,
故答案为:C4H10O;C4H10O;
(2)有机物A的分子式为C4H10O,可能为醚,也可能为醇.
若为醚,可以是CH3OCH2CH2CH3、CH3OCH(CH3)2、CH3CH2OCH2CH3,
若为醇,一定属于饱和一元醇,
丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,丁基异构数目等于丁醇的异构体数目,则丁醇的可能结构有4种,分别为:CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH,
故符合条件的同分异构体共有7种,
故答案为:7;
(3)A能与金属钠反应放出气体,为醇,有机物A分子内有2种不同环境的氢原子,为两种氢原子,符合条件的醇为C(CH3)3OH,
故答案为:C(CH3)3OH;
(4)C(CH3)3OH在浓硫酸的作用下发生消去反应,反应为:C(CH3)3OH$→_{△}^{浓硫酸}$C(CH3)2=CH2↑+H2O,
故答案为:C(CH3)3OH$→_{△}^{浓硫酸}$C(CH3)2=CH2↑+H2O;
(5)用乙烯制备氯乙烷的原理:CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,
故答案为:CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.
点评 本题主要考查了分子式的确定和分子结构的确定,注意物质的性质以及分子式的确定方法是解题关键,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “零号元素”在元素周期表中与氢元素占同一位置 | |
| B. | “四中子”的质量数为4,其质量比氢原子大 | |
| C. | “四中子”不显电性 | |
| D. | 第二种粒子的化学式为O4,与O2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、AlO2-、Cl-、SO42- | B. | Fe2+、HCO3-、K2、SO42- | ||
| C. | Na+、Cl-、AlO2-、NO3- | D. | NH4+、NO3-、I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
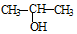 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2| A. | 只有① | B. | 只有①④ | C. | 只有①③④⑥ | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
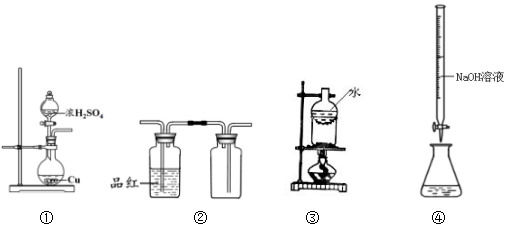
| A. | 用装置①制备SO2 | B. | 用装置②检验和收集SO2 | ||
| C. | 用装置③分离NaCl和I2 | D. | 用装置④测定溶液中c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为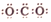 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com