
分析 ①NaHSO4为强酸酸式盐、②NaHCO3为弱酸强碱盐、③H2SO4为强酸、④Na2CO3为弱酸强碱盐、⑤NaOH为强碱.
(1)稀释10倍,PH=12,原溶液的PH=13;溶液pH<2的是
(2)0.1mol•L-1的NaHSO4溶液PH=1和0.1mol•L-1的NaOH溶液混合溶液呈中性;
(3)根据酸对水的电离起抑制作用,能水解的盐对水的电离起到促进作用,不水解的盐对水的电离无影响,水的电力程度越大,电离出的氢离子或是氢氧根离子浓度越大;
(4)混合后溶液的pH=2,溶液呈酸性,根据c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$计算.
解答 解:(1)pH=-lgc(H+),0.1mol•L-1的下列溶液:①NaHSO4溶液PH=1;②碳酸氢钠是强碱弱酸盐,碳酸氢根离子水解导致溶液呈碱性,所以溶液的PH>7,但水解程度较小,不可能完全水解,所以溶液的pH<13;③H2SO4溶液PH=1-lg2;④Na2CO3存在两步水解,NaHCO3只有一步水解,Na2CO3的PH大于NaHCO3,⑤NaOH溶液PH=13,体积均为10mL,加水稀释至100mL后,碱PH应减小1个单位,酸PH应增大1个单位,稀释后:①NaHSO4溶液PH=2;②NaHCO3溶液12<pH<13;③H2SO4溶液PH=2-lg2<2;④Na2CO3的PH大于NaHCO3,⑤NaOH溶液pH=13,所以溶液pH=12的是⑤NaOH溶液,溶液pH<2的是③H2SO4溶液,
故答案为:NaOH;H2SO4;
(2)0.1mol•L-1的NaHSO4溶液c(H+)=0.1mol•L-1,0.1mol•L-1的NaOH溶液c(OH-)=0.1mol•L-1,等体积混合,n(H+)=n(OH-)呈中性,
故答案为:NaHSO4、NaOH;
(3)H2SO4溶液、NaHSO4都是强电解质,能完全电离出氢离子,显示强酸性,对水的电离抑制程度最大,且硫酸电离出的氢离子是NaHSO4的两倍,故由水电离出的氢离子浓度最小的是H2SO4溶液;其次为NaHSO4,
NaHCO3和Na2CO3都是能水解的盐,对水的电离起到促进的作用,碳酸钠中碳酸根的水解程度大于碳酸氢钠中碳酸氢根离子的水解程度,所以碳酸钠对水的电离起到的促进作用大,由水电离出的氢氧根浓度是碳酸钠大于碳酸氢钠,综上由水电离出的氢离子浓度由大到小的顺序是④②①③,
故答案为:④②①③;
(4)H2SO4是二元强酸,0.1mol/L的H2SO4溶液中c(H+)=2c(H2SO4)=0.2mol/L,V1mL溶液中n(H+)=0.2V1×10-3mol,V2mL0.1mol/L NaOH溶液n(OH-)=0.1V2×10-3mol,混合时酸过量,pH=2,c(H+)=0.01mol/L,c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{V}$=$\frac{0.2{V}_{1}×1{0}^{-3}mol-0.1{V}_{2}×1{0}^{-3}mol}{({V}_{1}+{V}_{2})×1{0}^{-3}}$=0.01mol/L,$\frac{{V}_{1}}{{V}_{2}}$=$\frac{19}{11}$,
故答案为:$\frac{19}{11}$.
点评 本题考查了pH的简单计算,明确氢离子与氢氧根离子浓度的关系是解本题的关键,注意强酸弱碱盐和强碱弱酸盐水解较微弱,为易错点,题目难度中等.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器I、Ⅱ中N2物质的量关系为n(I•N2)=2n(Ⅱ•N2). | |
| B. | 容器I、Ⅱ中反应的平衡常数相同 | |
| C. | 容器I中的N2的转化率与容器Ⅱ中NH3的转化率之和小于1 | |
| D. | 容器I、Ⅲ中正反应速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、H+ | B. | K+、AlO22-、H+、Cl- | ||
| C. | Fe2+、H+、Cl-、NO3- | D. | Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液和盐酸 | B. | BaCl2溶液、盐酸、澄清石灰水 | ||
| C. | BaCl2溶液、AgNO3溶液 | D. | BaCl2溶液、盐酸、品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
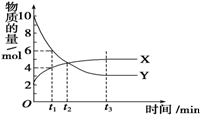 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )| A. | 反应的化学方程式为7Y?3X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,反应达到平衡状态,正、逆反应速率相等 | |
| D. | t3时,反应达到平衡状态,逆反应速率等于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
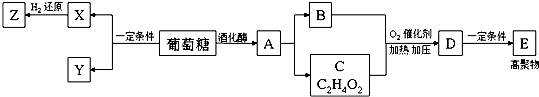
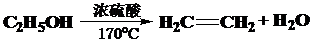 .
.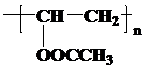 .
.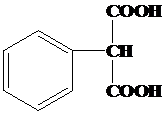 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com