
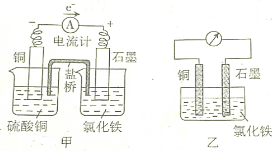
| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
分析 A、原电池的负极上发生失电子的氧化反应;
B、根据石墨电极发生的反应确定电极质量的变化;
C、甲装置左边烧杯中发生的反应:铜失电子得到铜离子;
D、原电池是将化学能转化为电能的装置.
解答 解:A、原电池的负极上发生失电子的氧化反应,甲、乙装置中的负极反应式Cu-2e-=Cu2+,相同,正极上都是Fe3++e-=Fe2+,故A错误;
B、石墨电极发生的反应:Fe3++e-=Fe2+,电极质量不变,故B错误;
C、甲装置左边烧杯中发生的反应:铜失电子得到铜离子,电解质里的阴离子移向负极,所以氯离子会移向该电极,甲装置左边烧杯中含有两种溶质:硫酸铜和氯化铜,故C正确;
D、甲、乙装置都是原电池,都是将化学能转化为电能的装置,故D错误.
故选C.
点评 本题考查学生原电池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL | B. | 45mL | C. | 65mL | D. | 80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ac.(填序号).
ac.(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外,还需要的其它玻璃仪器 |
| 12.5g | 250mL | 烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com