
| A、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ |
| B、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| C、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| D、碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、标准状况下,33.6 L H2O含有1.5NA个H2O分子 |
| B、根据反应KOCN+KOH+Cl2→CO2+N2+KCl+H2O 当有12mol电子转移时,生成N2分子数为2NA |
| C、常温常压下,22.4L NO2和N2O4混合气体含有的原子数为3NA |
| D、0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
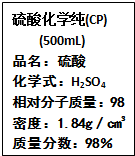 右图是某中学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
右图是某中学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸试剂的物质的量浓度为18.4 mol?L-1 |
| B、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C、50mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46mol |
| D、常温下2.7 gAl与足量的该硫酸反应可得到标准状况下的H2 3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+2HCl=ZnCl2+H2↑ | ||||
| B、Na2CO3+CaCl2=CaCO3↓+2NaCl | ||||
C、2H2O
| ||||
| D、H2+Cl2=2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 时间/min 物质 浓度 |
0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol?L-1 | 0.13mol?L-1 | 0.1mol?L-1 | 0.1mol?L-1 | 0.09mol?L-1 |
| H2 | 0mol?L-1 | 0.2mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 | 0.33mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2和水完全反应,转移电子数为2nA |
| B、0.5L0.2mol?L-1FeCl3溶液中,含Fe3+离子数为0.1nA |
| C、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA |
| D、常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com