
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
|
|
|
|
|
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
|
| A. | A | B. | B | C. | C | D. | D |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
下列措施能减慢化学反应速率的是
A.将煤块粉碎后燃烧
B.将食物贮藏在冰箱中
C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末
D.用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,
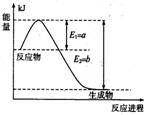
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为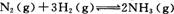 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示

铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
)短周期元素A、B,C、D的原子序数依次增大,它们的核电荷数之和为32,最外层电子数之和为10;A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,则下列叙述正确的是( )
|
| A. | D处于元素周期表第3周期ⅥA族 |
|
| B. | 四种元素原子的半径大小顺序是A<B<C<D |
|
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 |
|
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应叙述相符合的是( )
|
| A. | 图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
|
| B. | 图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
|
| C. | 图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
|
| D. | 图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
|
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 |
|
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
己知:|||+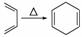 ,如果要合成
,如果要合成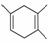 ,所用的起始原料可以是
,所用的起始原料可以是
①2甲基1,3丁二烯和2丁炔 ②1,3戊二烯 和2丁炔 ③2,3二甲基1,3戊二烯和乙炔 ④2,3二甲基1,3丁二烯和丙炔
和2丁炔 ③2,3二甲基1,3戊二烯和乙炔 ④2,3二甲基1,3丁二烯和丙炔
A、①④ B.②③ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com