
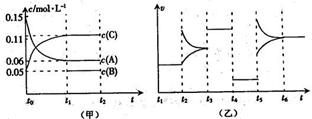
 A.反应的方程式为3A(g)+B(g) 2C(g)
A.反应的方程式为3A(g)+B(g) 2C(g)  B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。
B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:不详 题型:单选题
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0ΔS>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
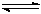 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)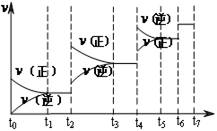
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+Q
CH3OH(g)+Q | A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1 N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是
3F+2G,用传感器测得该反应在不同pH条件下,物质D的浓度(用每升溶液所含溶质的质量表示,单位为mg/L)变化如图所示,下列有关说法正确的是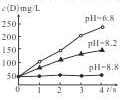
| A.pH=6.8时,D的浓度(mg/L)一定最大 |
| B.在pH相同的条件下,增大压强,D的浓度(mg/L)增大 |
| C.调节pH到8.8,可使该反应正、逆反应速率都为0 |
| D.温度相同时,不同pH条件下,该反应的平衡常数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com