
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
分析 发生反应:2KOH+H2SO4=K2SO4+H2O,根据方程式计算25mL溶液中KOH的物质的量,再计算1L溶液中KOH的物质的量,根据m=nM计算0.56g样品中KOH的质量,进而计算样品中KOH的纯度.
解答 解:24mL硫酸溶液中n(H2SO4)=24×10-3L×0.005mol/L=1.2×10-4mol,
由2KOH+H2SO4=K2SO4+H2O,可知25mL溶液中n(KOH)=2n(H2SO4)=2×1.2×10-4mol=2.4×10-4mol,
则1L溶液中KOH物质的量为2.4×10-4mol×$\frac{1000mL}{25mL}$=9.6×10-3mol,
故样品中KOH的纯度为$\frac{9.6×1{0}^{-3}mol×56g/mol}{0.56g}$×100%=96%,
故选:A.
点评 本题考查中和滴定有关计算,比较基础,注意对基础知识的理解掌.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期元素(除了稀有气体元素外),从左到右,原子半径依次减小 | |
| B. | 对于第三周期元素,从钠到氯,原子半径依次减小 | |
| C. | 各元素的原子半径总比其离子半径大 | |
| D. | 阴离子的半径大于其原子半径,阳离子的半径小于其原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
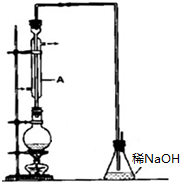 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 第一种方法 | 四氯化碳 | |
| 第二种方法 | 硫氰化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com