
| A. | 酯化反应也属于加成反应 | |
| B. | 酯化反应中酸脱去羟基,醇脱去氢原子 | |
| C. | 浓硫酸在酯化反应中只起催化剂的作用 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3 |
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH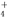 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A. (2b-a) mol/L B.(10b-5a) mol/L
C.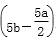 mol/L D.
mol/L D. mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
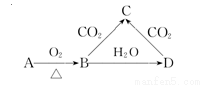
A.溶液呈碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min SO3/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
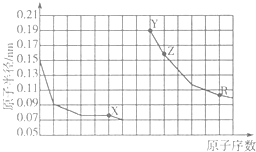
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
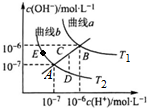
| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
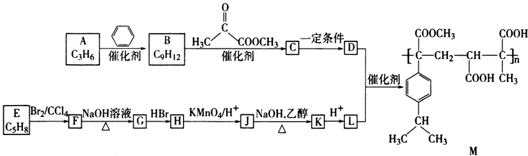
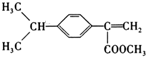 、
、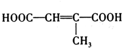 (写结构简式).
(写结构简式).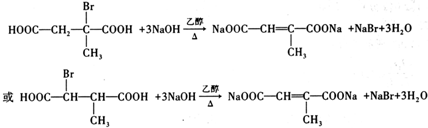 .
.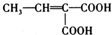 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
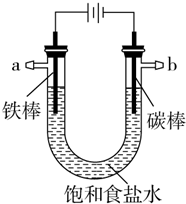 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com