
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol/L��4��������ҺpH���£�
���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
����˵������ȷ����
A. ������Һ�У�Na2CO3��Һ��ˮ�ĵ���̶����
B. NaHSO3��Һ�����Ե�ԭ���ǣ�����̶ȴ���ˮ��̶�
C. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH��С����H2SO3
D. ����ˮ�м�������Na2CO3(s)������������ˮ�д������Ũ��
���𰸡�D
��������������ͬŨ�ȵ�������ҺpH��С֪���������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-��A����ͬŨ�ȵ��⼸��������Һ�У���ҺpHԽ����ˮ�ĵ���̶�Խ���ݱ�������֪��ˮ�ĵ���̶�������̼������Һ��ѡ��A��ȷ��B��������������Һ�����ԣ�˵��HSO3-����̶ȴ���ˮ��̶ȣ�������������������������Ӳ��ֵ��룬NaHSO3=Na++HSO3-��HSO3-![]() H++SO32-��ѡ��B��ȷ��C���������ˮ��̶�Խ�����������Խ�����������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-�����Գ����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������HClO��Һ��pH��С����H2SO3��ѡ��C��ȷ��D���������̼���Ʒ�Ӧ����̼�����ƺʹ���������ʹ���ɵĴ������Ũ�ȼ�С��ѡ��D����ȷ����ѡD��
H++SO32-��ѡ��B��ȷ��C���������ˮ��̶�Խ�����������Խ�����������ˮ��̶ȴ�С˳���ǣ�CO32-��ClO-��HCO3-��HSO3-�������ǿ��˳����H2SO3��H2CO3��HClO��HCO3-�����Գ����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ��pH������HClO��Һ��pH��С����H2SO3��ѡ��C��ȷ��D���������̼���Ʒ�Ӧ����̼�����ƺʹ���������ʹ���ɵĴ������Ũ�ȼ�С��ѡ��D����ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��ȷ����
A. KClO3�TK++Cl��+3O2�� B. Ba(OH)2 = Ba2+ +��OH��2-
C. Na2SO4 =2Na+ + SO4-2 D. HNO3 =H+ + NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��2SO3(g) 2SO2(g) + O2(g) �������仯ͼ����ͼ�ó������������ȷ����
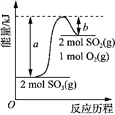
A. 2SO3(g) 2SO2(g) + O2(g) + (a��b) kJ
B. 1mol SO2��������1mol SO3��������
C. ����2mol SO3��ַ�Ӧ������(a��b) kJ����
D. �û�ѧ��Ӧ�����е������仯�����������з���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ�������ڳ�ʪ�����е�Ư����������O2������Cl2�������Ư�ۼ��Ⱥ�����ӦCa(ClO)2![]() CaCl2 + O2����
CaCl2 + O2����
ѧ����������ͼװ�ý���ʵ�飺����A���Թ���װ�еij�ʪƯ����Ʒʱ���۲쵽B���д������ݲ�����
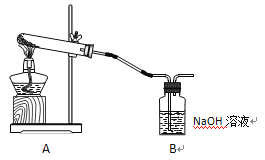
��1��B�з�����Ӧ�����ӷ���ʽΪ__________________________________________________��
��2����д��ʵ���Ҽ��������ķ�����_____________________________________________��
ѧ�������ʵ��ⶨij����Ư����Ʒ�д�����Ƶİٷֺ�����ʵ�鲽�����£�
������������������ΪW1g��
�������м�����Ʒ���ٳƣ�����ΪW2g��
���ظ����м��ȡ���ȴ��������ֱ�����أ�����ΪW3g��
��3������������������Ϊ_____________________��ʵ�鵽����ص��ж�������___________________________________________________��
��4����Ư����Ʒ�д�����Ƶİٷֺ���Ϊ_________________����W1��W2��W3��ʾ���������������ڱ�մ�������ֽ�����ʣ����ʵ���õĽ��__________________����ѡ����ƫ��������ƫС��������Ӱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ����ˮ��Ӧ:Na+H2O=Na+OH-+H2��
B. AlCl3��Һ�мӹ�����ˮAl3++3OH-=Al(OH)3��
C. ���Ȼ�������ͨ������ Fe2++Cl2=Fe3++2Cl-
D. ����Ͷ�뵽NaOH��Һ 2A1+2OH-+2H2O=2AlO2-+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȸʯ��Ҫ��Cu2(OH)2CO3����������Fe��Si�Ļ����ʵ�����Կ�ȸʯΪԭ���Ʊ�CuSO4��5H2O��CaCO3���������£�
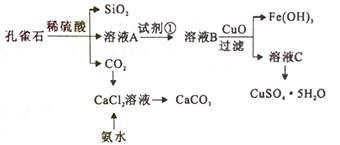
����˵����ȷ����
A. Ϊ����ҺA�е�Fe2+����ΪFe3+���Լ��ٿ�ѡ��˫��ˮ��������
B. ���������ӵ�CuO������Cu����
C. ����ҺC���CuSO4��5H2O����Ҫ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵȲ���
D. �Ʊ�CaCO3ʱ��Ӧ��CaCl2��Һ����ͨ��CO2���ټ��백ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������NaOH��������1.0mol/L��NaOH��Һ480mL��
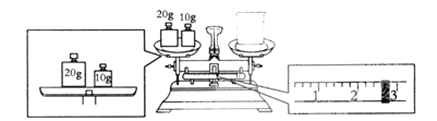
��1������ʱ������ʹ�õIJ���������________��________��________��________��
��2��Ҫ��ɱ�ʵ���ͬѧӦ�Ƴ�NaOH________g��
��3��ijͬѧ������NaOH��������������������ƽ�����ձ�����������ƽƽ����״̬��ͼ���ձ���ʵ������Ϊ________g��
��4��ʹ������ƿǰ������е�һ��������________��
��5������ʱ����ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�___________________________��
A����50mLˮϴ���ձ�2~3�Σ�ϴ��Һ��ע������ƿ
B����������ƽȷ��ȡ������������Ƶ�����������������ˮ�ܽ�����õ��������ƹ��壬�ò���������������ʹ�����ܽ⣬��ȴ
C��������ȴ����Һ�ز�����ע������ƿ�� D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1~2cm��
��6�������ƹ��������в������������ƫ�ߵ���________����������ţ�
��û��ϴ���ձ��Ͳ�����
��ת����Һʱ������������������ƿ����
������ƿ�����������������ˮ
�ܶ���ʱ���ӿ̶���
��δ��ȴ�����¾ͽ���Һת�Ƶ�����ƿ������
���ݺ�����ƿ������ҡ�ȣ����ú�Һ����ڿ̶��ߣ��ټ�ˮ���̶��ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ����Ϳ�ϡ�����������Ӧ�÷dz��㷺�ĺ�ɫ�������������ˮ�ʹ����������ᡢ�Ȼ������ˮ���ױ�O2�� ������������һ������ͭ��ʯ(��CuFeS2��Cu2S ��) Ϊԭ����ȡCu2O �Ĺ����������£�
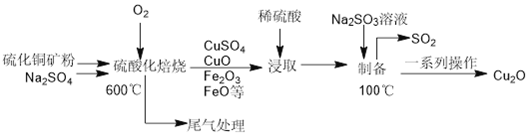
��1�� �����ữ������ʱ��CuS ��O2��Ӧ����CuSO4�����ʵĻ�ѧ����ʽΪ________________����100��ʱ��������Ӧ�����ӷ���ʽΪ________________________________��
��2������Na2SO4�����ó���С���ϼ����⣬��һ��Ҫ������_____________________��
��3�� ����ȡ��ʱΪ���ͭ�Ľ�ȡ�ʣ��������Һ�����ʵ���֮���⣬�������________________ (�����о�����)��
��4���õ���ƷCu2O��һϵ�в�����Ҫ��___________________________________��
��5�������й�˵����ȷ����______________
A������ʱ�õ���β�����ü�Һ���Դ���
B��Cu2O¶�����ڿ����л���
C����һϵ�в����õ���ƷCu2O��ĸ���Ʒ���������������ˮ��
D�����Ʊ���ʱ����Һ��pHԽС��Cu2O �IJ���Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li������Ĺ������������Li��Ϊ�������ϵĵ�ؾ���С���ᡢ�����ܶȴ���������ܣ��õ��㷺Ӧ�á��ش��������⣺
��1������Liԭ�ӵ����Ų�ͼ��ʾ��״̬�У�������ͺ���ߵķֱ�Ϊ_____��_____�����ţ���
A��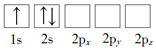 B��
B��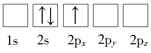
C��![]() D��
D��![]()
��2��Li+��H������ͬ�ĵ��ӹ��ͣ�r(Li+)С��r(H)��ԭ����______��
��3��LiAlH4���л��ϳ��г��õĻ�ԭ����LiAlH4�е������ӿռ乹����______������ԭ�ӵ��ӻ���ʽΪ______��LiAlH4�У�����_____�����ţ���
A�����Ӽ� B���Ҽ� C���м� D�����
��4��Li2O�����Ӿ��壬�侧���ܿ�ͨ��ͼ(a)��BornHaberѭ������õ���
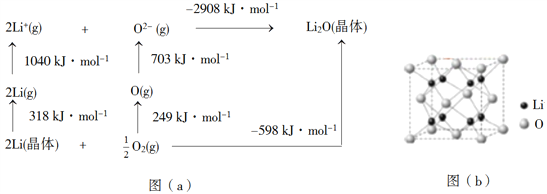
��֪��Liԭ�ӵĵ�һ������Ϊ________kJ��mol1��O=O������Ϊ______kJ��mol1��Li2O������Ϊ______kJ��mol1��
��5��Li2O���з�өʯ�ṹ��������ͼ(b)��ʾ����֪��������Ϊ0.4665 nm�������ӵ�������ֵΪNA����Li2O���ܶ�Ϊ______g��cm3���г�����ʽ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com