
 一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )
一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )| A. | 正反应△H>0 | |
| B. | 平衡常数K(T2)<K(T1) | |
| C. | T2时,达到平衡时A的转化率为33.3% | |
| D. | T2时,该反应的化学平衡常数为0.8 |
分析 由图可知,温度为T2先到达平衡,所以T1<T2,温度越高,平衡时A的物质的量浓度越小,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,正反应为放热反应,结合三行式分析解答.
解答 解:A、温度为T2先到达平衡,所以T1<T2,温度越高,平衡时A的物质的量浓度越小,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,所以△H>0,故A正确;
B、正反应是吸热反应温度越高K值越大,所以K(T2)>K(T1),故B错误;
C、A的转化率为$\frac{0.6-0.2}{0.6}×100%$=66.6%,故C错误;
D、T2时,该反应的化学平衡时,A的浓度为0.1mol/L,B、C的浓度都为0.2mol/L,所以化学平衡常数K=$\frac{0.2×0.2}{0.1}$=0.4,故D错误;
故选A.
点评 本题考查了化学平衡图象问题、化学平衡常数的有关计算、外界条件对平衡移动影响等,难度中等,根据图象判断反应为放热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.


科目:高中化学 来源: 题型:解答题
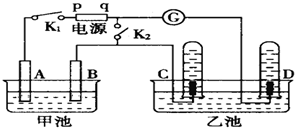
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的燃烧过程均是放热的 | |
| B. | 需要点燃才能发生的燃烧过程是吸热的 | |
| C. | 所有燃料在燃烧过程中均会发生化学键的断裂 | |
| D. | 燃烧后产物的总能量一定小于反应物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向沸水中滴加饱和氯化铁溶液制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiNiO2中Ni的化合价是+1 | |
| B. | 该反应中LiOH是还原剂 | |
| C. | OH-和Li+含有的电子数相同 | |
| D. | 该反应生产1mol LiNO2时转移1 mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | ①②③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却至室温就转移至容量瓶 | |
| B. | 容量瓶中存在少量蒸馏水 | |
| C. | 硫酸转移至容量瓶后,没有洗涤烧杯 | |
| D. | 定容时俯视刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 酸奶中富含乳酸,乳酸分子的结构简式如图所示请回答:
酸奶中富含乳酸,乳酸分子的结构简式如图所示请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com