
| A. | NaH在水中显酸性 | |
| B. | NaH中氢离子电子层排布与氦原子的不同 | |
| C. | NaH中氢离子半径比锂离子大 | |
| D. | NaH中氢离子可被还原成氢气 |
分析 NaH中Na为+1价,则H为-1价,具有还原性,与水反应生成氢气和NaOH,为H元素之间发生氧化还原反应,水为氧化剂,以此解答该题.
解答 解:A.NaH与水反应生成氢气和氢氧化钠,溶液呈碱性,故A错误;
B.NaH中氢离子核外有2个电子,电子层排布与氦原子相同,故B错误;
C.NaH中氢离子与锂离子的电子排布相同,锂离子原子核中正电荷多半径小,即氢离子半径比锂离子大,故C正确;
D.NaH中氢离子为-1价,为最低价态,可被氧化,被氧化成氢气,故D错误.
故选C.
点评 本题考查氧化还原反应、半径比较,为高考高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: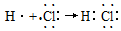 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2CH2OH+HBr $\stackrel{△}{→}$CH3CH2CH2Br+H2O | |
| B. | 服用阿司匹林过量出现水杨酸(  )中毒反应,可静脉注射 NaHCO3溶液: )中毒反应,可静脉注射 NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向丙氨酸钠中加入足量盐酸: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~t1min内X与Y的平均反应速率之比为3:2 | |
| B. | t2时刻改变的条件可能是压强或催化剂 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 该反应中Z一定为产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁和稀盐酸反应:S2-+2 H+→H2S↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质属于芳香族化合物,分子式为C13H14O4Cl2 | |
| B. | 该物质分子内处于同一平面的碳原子不超过7个 | |
| C. | 1mol该物质最多可与5molH2发生加成反应 | |
| D. | 1mol该物质最多可与含3molNaOH的水溶液发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com