
| A. | 常温常压下,16g O2与16g O3所含的原子数均是NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA | |
| C. | 标准状况下,2.24LCCl4所含原子数为0.5NA | |
| D. | 标准状况下,22.4 L氦气所含有的质子数目约为4×6.02×1023 |
分析 A.质量转换成物质的量,结合氧气和臭氧的组成分析,依据氧元素守恒计算;
B.溶液体积不知,不能计算微粒数;
C.标准状况下四氯化碳不是气体;
D.氦气是单原子分子,结合n=$\frac{V}{22.4}$=$\frac{N}{{N}_{A}}$计算.
解答 解:A.16g O2和O3所含的氧原子的质量为16g,含有1mol氧原子,含有的原子数为NA,故A正确;
B.物质的量浓度为0.5mol/L的MgCl2溶液中,溶液体积不知不能计算Cl-个数,故B错误;
C.标准状况下,2.24LCCl4物质的量不是0.1mol,故C错误;
D.标准状况下,22.4 L氦气物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,氦气是单原子分子,所含有的质子数目约为2×6.02×1023,故D错误;
故选A.
点评 本题考查了阿伏加德罗常数的有关计算和应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意物质的构成和性质,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | NaH中的H为+1价 | |
| C. | 氧化剂是H2O | |
| D. | 每摩尔NaH参加反应时电子转移数为1e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同位素 | B. | 氘(D)原子核外有1个电子 | ||
| C. | H与 D中子数不同 | D. | H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
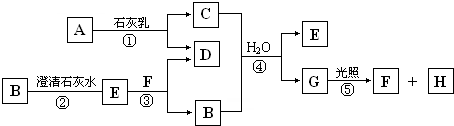
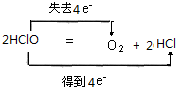 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2属于大气污染物 | B. | 酸雨是PH小于7的雨水 | ||
| C. | CO2、NO2或SO2都会导致酸雨的形成 | D. | NO2造成光化学烟雾的主要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
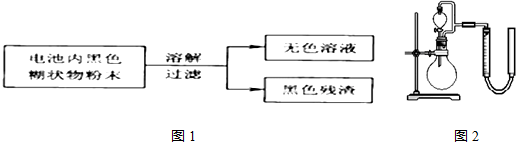
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com