
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示.下列说法正确是( ) 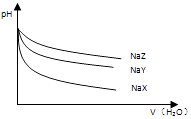
A.在上述三种盐原溶液中,水的电离程度大小是NaX>NaY>NaZ
B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z﹣)>c(Y﹣)>c(X﹣)
C.在上述NaX和NaY的混合液中存在 ![]() =
= ![]()
D.在0.2molL﹣1 NaX溶液中加 入等体积0.1molL﹣1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH﹣)+c(Cl﹣)
【答案】D
【解析】解:由图象可以看出,pH相同的NaX、NaY和NaZ溶液,稀释后pH的变化程度不相同,因此可以判断NaX、NaY、NaZ的浓度不同,由于NaZ的pH变化最小,说明NaZ的浓度最大且弱酸根Z﹣的水解程度最小,X﹣的水解程度最大,注意这里需要和等浓度的NaX、NaY、NaZ三种盐溶液的比较进行区分,如果是等浓度的话,那么pH变化最大的应该是水解程度最小的.
A.由于三种盐溶液pH相同,因此对水的电离的促进作用是相同的,所以NaX、NaY和NaZ溶液中水的电离度大小是相同的,故A错误;
B.等物质的量浓度的NaX、NaY、NaZ混合液中,酸根离子水解程度越大,其溶液中酸根离子浓度越小,所以离子浓度的大小关系是c(Z﹣)<c(Y﹣)<c(X﹣),故B错误;
C.在 ![]() 可表示X﹣水解的百分含量或水解程度,
可表示X﹣水解的百分含量或水解程度, ![]() 可表示Y﹣水解的百分含量或水解程度,而X﹣和Y﹣的水解程度是不相同的,所以两者不相等,故C错误;
可表示Y﹣水解的百分含量或水解程度,而X﹣和Y﹣的水解程度是不相同的,所以两者不相等,故C错误;
D.在0.2molL﹣1 NaX溶液中加入等体积0.1molL﹣1的盐酸反应后溶液中的溶质是等物质的量浓度的NaX、NaCl、HX,根据电荷守恒得c(H+)+c(Na+)=c(OH﹣)+c(Cl﹣)+c(X﹣),根据物料守恒得c(Na+)=c(HX)+c(X﹣)=2c(Cl﹣),所以得c(H+)+c(HX)=c(OH﹣)+c(Cl﹣),故D正确;
故选D.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是
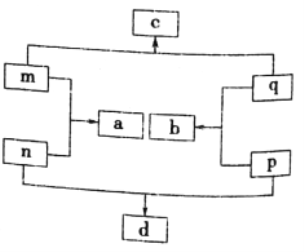
A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
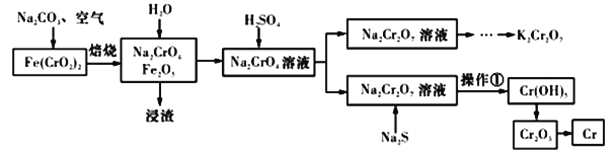
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________。焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)判断加入稀硫酸的量已经足量的标准是_______________________________________。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是调节溶液的酸碱度和_____________________。
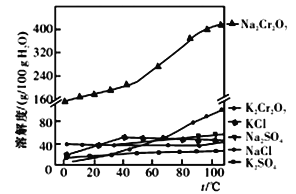
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水):
步骤①除杂质:__________________________________________________________________;
步骤②制备K2Cr2O7固体:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰于电池内部的黑色物质A主要含有MnO2、MnOOH、NH4Cl、ZnCl2、炭粉,用A制备高纯MnCO3的流程圈如下:
![]()
(1)锌锰干电池的负极材料是__________(填化学式)。
(2)第I步操作得滤渣的成分是______;第II步在空气中灼烧的目的除了将MnOOH转化为MnO2外,另一作用是__________。
(3)步骤I中制得MnSO4溶液,该反应的化学方程式为____________。用草酸(H2C2O4)而不用双氧水(H2O2)作还原剂的原因是_________。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第IV步多步操作可按以下步骤进行:
操作l:加入NH4HCO3溶液调节溶液pH<7.7,充分反应直到不再有气泡产生;
操作2:过滤,用少量水洗涤沉淀2~3次;
操作3:检测滤液;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①操作1发生反应的离子方程式为_________;若溶液pH>7.7,会导致产品中混有____(填化学式)。
②操作3中,检测MnCO3是否洗净的方法是___________。
③操作4用少量无水乙醇洗涤的作用是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com