
【题目】溶液、胶体和浊液这三种分散系的本质区别是( )
A. 是否为大量分子和离子的集合体
B. 分散质粒子的大小
C. 能否通过滤纸或半透膜
D. 是否均一、稳定、透明
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛的用途。
(1)反应C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)![]() 2CO(g)△H=+172.5kJmol-1
2CO(g)△H=+172.5kJmol-1
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= kJmol-1。
CO2(g)+H2(g)的△H= kJmol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)__________v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K= ;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、 “减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
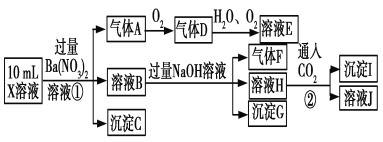
下列说法正确的是
A.气体A是NO2
B.X中肯定存在Fe2+、Al3+、NH![]() 、SO
、SO![]()
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)E在周期表中的位置为 。
(2)下列说法正确的有 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 。
(5)A与B可形成一种二元化合物X,其中A元素质量分数为2.33%.据研究X显弱酸性。回答:
①X的电离方程式为 __。
②X电离的阴离子结构与二氧化碳相似,则其电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.______________________ _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分散系最不稳定的是( )
A. 向CuSO4溶液中加入NaOH溶液得到的分散系
B. 向水中加入食盐得到的分散系
C. 向沸水中滴入饱和FeCl3溶液得到的红褐色液体
D. 向NaOH溶液中通入CO2得到的无色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含电子数与 个H2O分子中所含电子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是 mol。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 。
(4)标准状况下,①4 g氢气、②33.6 L甲烷(CH4)、③6.02×1023个水分子中,含原子数最多的是_________(填序号)。
(5)在标准状况下,将224L HCl气体溶于635mL(ρ=1.00gcm-3)的水中,所得盐酸的密度为1.20gcm-3。求该盐酸的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com