
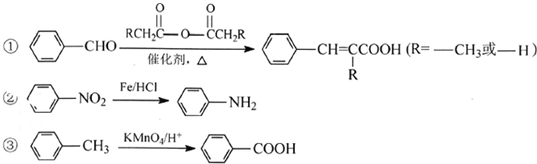
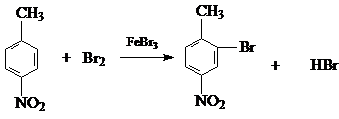 .
.  .
. 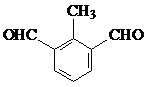 、
、 .
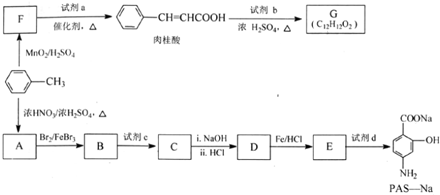
. 分析 由反应的流程可看出:根据信息② 在MnO2/H2SO4条件下氧化为F
在MnO2/H2SO4条件下氧化为F ,
, 和H3COOOCCH3反应得
和H3COOOCCH3反应得 ,
, 和丙烯醇酯化得G;
和丙烯醇酯化得G; 和浓硝酸发生硝化反应生成A,结构简式为
和浓硝酸发生硝化反应生成A,结构简式为 ,
, 和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,据此分析解答.
和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,据此分析解答.
解答 解:由反应的流程可看出:根据信息② 在MnO2/H2SO4条件下氧化为F
在MnO2/H2SO4条件下氧化为F ,
, 和H3COOOCCH3反应得
和H3COOOCCH3反应得 ,
, 和丙烯醇酯化得G;
和丙烯醇酯化得G; 和浓硝酸发生硝化反应生成A,结构简式为
和浓硝酸发生硝化反应生成A,结构简式为 ,
, 和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,
和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,
(1)A和Br2取代发生生成B的方程式是: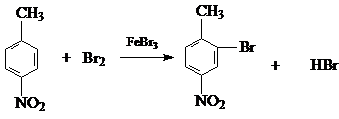
故答案为: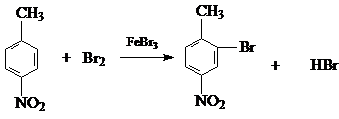
(2)根据以上分析,C中含有羧基和溴原子,所以和氢氧化钠溶液水解、中和的方程式为:
故答案为:
(3)由新信息及流程推断,F为 ,其中一定含有醛基,F生成肉桂醛根据信息②,则试剂a是乙酸酐,结构简式为CH3COOOCCH3,
,其中一定含有醛基,F生成肉桂醛根据信息②,则试剂a是乙酸酐,结构简式为CH3COOOCCH3,
故答案为:醛基;H3COOOCCH3;
(4)试剂b的相对分子质量为58,分子中不含甲基,且为链状结构可推知,是丙烯醇,即CH2=CHCH2OH,则方程式为:,
故答案为:;
(5)肉桂酸的同分异构体,能发生银镜反应,且1mol该有机物最多生成4mol Ag,说明含有2个醛基,又苯环上有三个取代基,所以连有两个醛基和一个甲基,由三个基团的相对位置不同,这样的同分异构体应有6种;
苯环上有两种等效氢的有两种,即 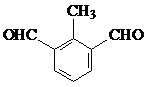

故答案为: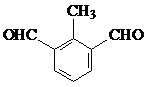

点评 本题考查有机物合成及结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,注意合成流程中官能团及结构的变化,侧重分析能力及知识迁移能力的考查,(5)中同分异构体的判断解答的难点,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
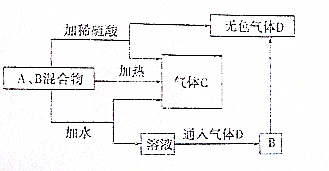 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:实验题
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
① 甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
② 乙直接加热饱和FeCl3溶液。
③ 丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法更合理: ,可以利用胶体的什么性质来证明有Fe(OH)3胶体生成? 。
(2)Fe(OH)3胶体稳定存在的主要原因是_________________。
A.胶粒直径小于1 nm B.胶粒带正电荷 C.胶粒作布朗运动 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是____________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间 B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系 D.Fe(OH)3胶体的分散质能透过滤纸
(4)提纯所制Fe(OH)3胶体常用的方法是________,若 向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
实验室有一瓶溶液,标签上标有“BaCl2 0.2 mol·L-1”的字样,下面是某同学对该溶液的叙述,正确的是( )
A. 配制500mL该溶液,可将0.1 mol BaCl2溶于500mL水中
B.Ba2+和Cl-的物质的量浓度都是0.1 mol·L-1
C.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2 mol·L-1
D.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检查装置的气密性--制取气体、验证气体的性质等与气体有关的实验操作 | |
| B. | 检查是否漏水--滴定管、容量瓶、分液漏斗等的使用 | |
| C. | 验纯--点燃可燃性气体 | |
| D. | 湿润--用石蕊试纸、碘化钾淀粉试纸和pH 试纸检验或验证某些气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 若电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | ${K}_{{a}_{1}}$=4.30×107 ${K}_{{a}_{2}}$=5.61×10-11 | Kh=1.77×10-5 |
| A. | 由数据可判断该溶液呈酸性 | |
| B. | c(NH4+)>c(HCO32-)>c(CO32-)>c(NH3•H2O) | |
| C. | c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯、干冰均为纯净物 | |
| B. | NO2、CO、CO2均为酸性氧化物 | |
| C. |  与 与 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于羧基类的有2种 | |
| B. | 属于酯类的有3种 | |
| C. | 存在分子中含有六元环的同分异构体 | |
| D. | 分子中可含有两种不同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com