
C”¢H2”¢CH4¶¼ŹĒÓÅÖŹµÄÄÜŌ“ĪļÖŹ£¬ÄæĒ°¶ŌÕāČżÖÖĪļÖŹµÄŃŠ¾æŹĒČ¼ĮĻŃŠ¾æµÄÖŲµć£¬ĻĀĮŠ¹ŲÓŚÕāČżÖÖĪļÖŹµÄŃŠ¾æ·½ĻņÖŠæÉŠŠµÄŹĒ(””””)
A£®Ń°ÕŅÓÅÖŹ“߻ƼĮ£¬Ź¹CO2ÓėH2O·“Ӧɜ³ÉCH4ÓėO2£¬²¢·Å³öČČĮæ
B£®Ń°ÕŅÓÅÖŹ“߻ƼĮ£¬ŌŚ³£ĪĀ³£Ń¹ĻĀŹ¹CO2·Ö½āÉś³ÉĢ¼ÓėO2
C£®Ń°ÕŅÓÅÖŹ“߻ƼĮ£¬ĄūÓĆĢ«ŃōÄÜŹ¹“óĘųÖŠµÄCO2Óėŗ£µ×æŖ²ÉµÄCH4ŗĻ³ÉŗĻ³ÉĘų(CO”¢H2)
D£®½«¹ĢĢ¬Ģ¼ŗĻ³ÉĪŖC60£¬ŅŌC60×÷ĪŖČ¼ĮĻ

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®ĖįŠŌŃõ»ÆĪļŅ»¶ØŹĒ·Ē½šŹōŃõ»ÆĪļ B£®¼īŠŌŃõ»ÆĪļŅ»¶ØŹĒ½šŹōŃõ»ÆĪļ
C£®·Ē½šŹōŃõ»ÆĪļŅ»¶ØŹĒĖįŠŌŃõ»ÆĪļ D£®½šŹōŃõ»ÆĪļŅ»¶ØŹĒ ¼īŠŌŃõ»ÆĪļ
¼īŠŌŃõ»ÆĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ¹ŲÓŚČõµē½āÖŹµÄµēĄėĘ½ŗā³£ŹżµÄŠšŹöÖŠ£¬ÕżČ·µÄŹĒ( )
A.ŅņĪŖµēĄėŹĒĪüČČµÄ£¬ĖłŅŌĪĀ¶ČŌ½øߣ¬Ķ¬Ņ»Čõµē½āÖŹµÄµēĄėĘ½ŗā³£ŹżŌ½Š”
B.Čõµē½āÖŹµÄµē ĄėĘ½ŗā³£ŹżÖ»ÓėČõµē½āÖŹµÄ±¾ŠŌ¼°Ķā½ēĪĀ¶ČÓŠ¹Ų
ĄėĘ½ŗā³£ŹżÖ»ÓėČõµē½āÖŹµÄ±¾ŠŌ¼°Ķā½ēĪĀ¶ČÓŠ¹Ų
C.Ķ¬Ņ»ĪĀ¶ČĻĀ£¬ČõĖįµÄµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ĖįŠŌŌ½Ē棻Čõ¼īµÄµēĄėĘ½ŗā³£ŹżŌ½“󣬼īŠŌŌ½Čõ
D.¶ąŌŖČõĖįµÄø÷¼¶µēĄė³£ŹżĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°Ń0.05 mol NaOH¹ĢĢå·Ö±š¼ÓČėµ½100 mLĻĀĮŠŅŗĢåÖŠ£¬ČÜŅŗµÄµ¼µēÄÜĮ¦±ä»Æ×īŠ”µÄŹĒ( )
A.×ŌĄ“Ė®
B.0.5 mol”¤L-1ŃĪĖį
C.0.5 mol”¤L-1 CH3COOHČÜŅŗ
D.0.5 mol”¤L-1 KClČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÕżĪóÅŠ¶Ļ£¬ÕżČ·µÄ“ņ”°”Ģ”±£¬“ķĪóµÄ“ņ”°”Į”±
(1)ĖłÓŠµÄČ¼ÉÕ·“Ó¦¶¼ŹĒ·ÅČČ·“Ó¦£¬ĖłŅŌ²»ŠčŅŖ¼ÓČČ¾ĶÄܽųŠŠ(””””)
(2)·“Ó¦ĪļµÄ×ÜÄÜĮæµĶÓŚÉś³ÉĪļµÄ×ÜÄÜĮæŹ±£¬Ņ»¶Ø²»ÄÜ·¢Éś·“Ó¦(””””)
(3)ĪļĄķ±ä»Æ¹ż³ĢÖŠ£¬Ņ²æÉÄÜÓŠČČĮæµÄ±ä»Æ(””””)
(4)C(ŹÆÄ«£¬s)===C(½šøÕŹÆ£¬s)””¦¤H>0£¬ĖµĆ÷ŹÆÄ«±Č½šøÕŹÆĪȶØ(””””)
(5)Ņ»øö·“Ó¦µÄģŹ±äŅņ·“Ó¦ĪļµÄÓĆĮæŗĶ·“Ó¦Ģõ¼žµÄøıä¶ų·¢Éśøıä(””””)
(6)“߻ƼĮÄÜøı䷓ӦµÄģŹ±ä(””””)
(7)ŅŃÖŖS(l)£«O2(g)===SO2(g)””¦¤H£½£293.23 kJ·mol£1£¬ŌņS(s)£«O2(g)===SO2(g)·“Ó¦·Å³öµÄČČĮæ“óÓŚ293.23 kJ·mol£1(””””)
(8)Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬H2(g)£«Cl2(g)===2HCl(g)£¬ŌŚ¹āÕÕŗĶµćČ¼Ģõ¼žĻĀµÄ¦¤H²»Ķ¬(””””)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
·“Ó¦A£ŗ4HCl£«O2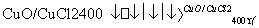 2Cl2£«2H2O
2Cl2£«2H2O
ŅŃÖŖ£ŗⅰ.·“Ó¦AÖŠ£¬ 4 mol HCl±»Ńõ»Æ£¬·Å³ö115.6 kJµÄČČĮ攣
ⅱ.

(1)·“Ó¦AµÄČČ»Æѧ·½³ĢŹ½ŹĒ____________________________________________________”£
(2)¶ĻæŖ1 mol H—O ¼üÓė¶ĻæŖ 1 mol H—Cl ¼üĖłŠčÄÜĮæĻą²īŌ¼ĪŖ________kJ£¬H2OÖŠH—O ¼ü±ČHClÖŠH—Cl¼ü(Ģī”°Ēæ”±»ņ”°Čõ”±)________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŅĄ¾ŻČČ»Æѧ·½³ĢŹ½µĆ³öµÄ½įĀŪÕżČ·µÄŹĒ(””””)
A£®ŅŃÖŖ2SO2(g)£«O2(g)2SO3(g)ĪŖ·ÅČČ·“Ó¦£¬ŌņSO2µÄÄÜĮæŅ»¶ØøßÓŚSO3µÄÄÜĮæ
B£®ŅŃÖŖC(ŹÆÄ«£¬s)===C(½šøÕŹÆ£¬s)””¦¤H>0£¬Ōņ½šøÕŹÆ±ČŹÆÄ«ĪȶØ
C£®ŅŃÖŖH£«(aq)£«OH£(aq)===H2O(l)””¦¤H£½£57.3 kJ·mol£1£¬ŌņČĪŗĪĖį¼īÖŠŗĶ·“Ó¦µÄČČŠ§Ó¦¾łĪŖ57.3 kJ
D£®ŅŃÖŖ2C(s)£«2O2(g)===2CO2(g)””¦¤H1,2C(s)£«O2(g)===2CO(g)””¦¤H2£¬Ōņ¦¤H1<¦¤H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĪļÖŹ¼äµÄ·“Ó¦æĻ¶ØĪŽĆ÷ĻŌŹµŃéĻÖĻóµÄŹĒ £Ø £©
A£®¼ÓČČ¾SO2ĘÆ°×µÄĘ·ŗģŹŌŅŗ
B£®½«ÉŁĮæSO2ĶØČėNaOHČÜŅŗÖŠ
C£®½«ŠĀÖʵÄĀČĖ®ŌŚŃō¹āĻĀÕÕÉä
D£®½«“ņÄ„µÄĀĮʬ¼ÓČėÅØNaOHČÜŅŗÖŠŅ»¶ĪŹ±¼ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¢ÅŅŃÖŖ·“Ó¦¢ń£ŗ4NH3(g)+3O2(g)==2N2(g)+6H2O(g) ”÷H=£1266.8kJ/mol
·“Ó¦¢ņ£ŗN2(g) + O2(g)== 2NO(g) ”÷=£«180.5kJ/mol
ĖüĆĒµÄĘ½ŗā³£ŹżŅĄ“ĪĪŖK1”¢K2
¢ŁŠ“³ö°±øßĪĀ“ß»ÆŃõ»ÆÉś³ÉNOµÄČČ»Æѧ·½³ĢŹ½ £¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżµÄ±ķ“ļŹ½K= (ÓĆŗ¬K1”¢K2µÄ“śŹżŹ½±ķŹ¾)”£
¢Ś·“Ó¦¢ńæÉÉč¼Ę³ÉČ¼ĮĻµē³Ų£¬ČōøƵē³ŲŅŌKOHČÜŅŗ×÷µē½āÖŹČÜŅŗ£¬Ōņøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ ”£øƵē³ŲŹ¹ÓĆ¹ż³ĢÖŠ£¬Õż¼«ø½½üČÜŅŗµÄpH½« £ØĢī”°Éżøß”±”¢”°½µµĶ”±»ņ”°²»±ä”±£©”£
¢ĘŅŃÖŖ£ŗN2(g) +3H2(g)  2NH3(g) ”÷H=£92kJ/mol”£
2NH3(g) ”÷H=£92kJ/mol”£
¢ŁĪŖĢįøßH2µÄ×Ŗ»ÆĀŹ£¬ŅĖ²ÉČ”µÄ“ėŹ©ÓŠ £ØĢī×ÖÄø£©
A£®¼°Ź±ŅĘ³ö°± B£®ÉżøßĪĀ¶Č C£®Ź¹ÓĆ“ß»Æ¼Į D£®Ń»·ĄūÓĆŗĶ²»¶Ļ²¹³äN2
¢ŚŌŚŅ»¶ØĪĀ¶Č”¢Ń¹ĒæĻĀ£¬½«N2ŗĶH2°“Ģå»ż±Č1:3ŌŚĆܱÕČŻĘ÷ÖŠ»ģŗĻ£¬µ±·“Ó¦“ļĘ½ŗāŹ±£¬²āµĆĘ½ŗā»ģŗĻĘųĢåÖŠNH3µÄĢå»ż·ÖŹżĪŖ25%£¬“ĖŹ±H2µÄ×Ŗ»ÆĀŹĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com