
(7分)按要求填写
(1)元素所在的周期序数= ;主族元素所在的族序数= ;
(2)写出最活泼的非金属元素在周期表中的位置___________
(3)指出下列过程中的能量转化形式
①高温分解水 ②甲烷的燃烧
(4)在一定温度下,1molCO气体与1mol水蒸气在催化剂存在下完全反应,生成CO2气体和氢气,放热41kJ的热化学方程式为:
__________________________________________________________________
(1)电子层数;最外层电子数;(2第二周期第ⅦA族
(3)① 热能转化为化学能 ② 化学能转化为热能、光能
(4)CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ·mol-1
【解析】(1)考查周期和族的含义。元素所在的周期序数=电子层数;主族元素所在的族序数=最外层电子数。
(2)最活泼的非金属元素是氟元素,位于周期表的第二周期第ⅦA族。
(3)①高温分解水是吸热反应,热能转化为化学能;②甲烷的燃烧,化学能转化为热能、光能。
(4)根据题意可知,该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ·mol-1。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
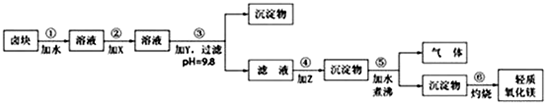
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
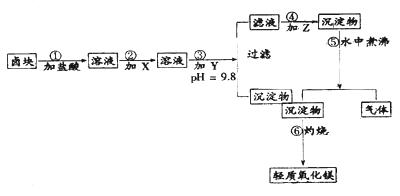
轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
| 试剂 | 价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:
查看答案和解析>>
科目:高中化学 来源: 题型:
A为芳香烃的衍生物,只含有C、H、O三种元素,苯环上只有两种取代基,并且这两种取代基处于邻位,A的相对分子质量为164.A不能使FeCl3溶液变色,但可被银氨溶液氧化为B;B能在浓H2SO4存在和加热条件下发生分子内的酯化反应生成C,C分子中除苯环外还有一个含氧的六元环 。
(1)B分子中的含氧官能团是 ;
(2)A的苯环上两个取代基中的碳原子总数是(填数字)__________________;
(3)满足题意要求的A的结构有 种。
(4)试写出其中的任意两种A及其对应的C的结构简式(请按对应关系分组填写)
第一组A________________________ C____________________________
第二组A________________________ C____________________________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷(带解析) 题型:填空题
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:

表1 化学试剂价格表
| 试剂 | 价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
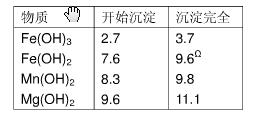
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9. 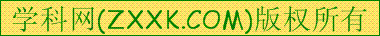 6 6 | 3.7 9.6Ω 9.8 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)利用农作物加工成的植物纤维A,有如下转化,其中B是A水解的最终产物,C的化学式为![]() ,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物。(图中部分反应条件及产物没有列出)
,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物。(图中部分反应条件及产物没有列出)
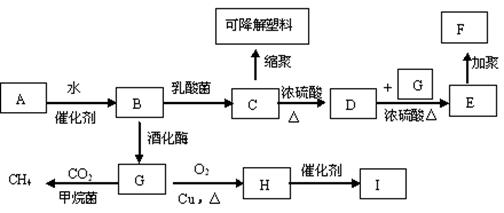
(1)写出下列物质的结构简式
高分子化合物F___________________ 六元环状化合物I___________________
(2)写出下列反应的化学方程式
A→B________________________________________________________
C→可降解塑料_________________________________________________。
(3)H分子所含官能团的名称是___________,实验室中常用于检验该官能团的试剂的名称是(只写一种)_____________ _________。
(4)写出同时满足下列条件的C的同分异构体的结构简式
①3个氧原子分别连在3个碳原子上 ②1mol该物质与足量的钠反应生成1mol氢气
③核磁共振氢谱测得5个吸收峰
(5)某同学设计由G合成![]() 的合成路线如下:(按要求填写,( )内填写反应类型,方框内填写Ⅱ和Ⅳ的结构简式)
的合成路线如下:(按要求填写,( )内填写反应类型,方框内填写Ⅱ和Ⅳ的结构简式)
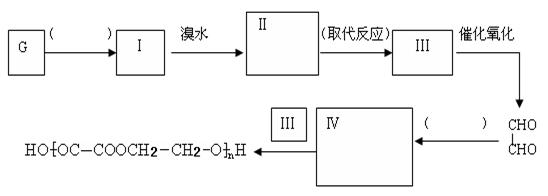
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com