
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
【答案】D
【解析】
A.电解饱和食盐水生成NaOH、H2和Cl2,则(1)中黑色固体变红发生的反应为CuO+H2![]() Cu+H2O,故A正确;
Cu+H2O,故A正确;
B.(1)中黑色固体变红,则a极有H2生成,a为阴极,发生的电极反应为2H2O+2e-=H2↑+2OH-,a极周围溶液中的Mg2+和OH-发生离子反应生成Mg(OH)2↓,故电极a附近溶液出现浑浊,故B正确;
C.b为阳极,有Cl2生成,则(3)中发生的离子反应为Cl2+S2-=S↓+2Cl-,可观察到(3)中溶液出现浑浊,故C正确;
D.(4)中发生的化学反应为2NaOH+Cl2=NaCl+NaClO+H2O,NaClO有漂白性,所以C中溶液红色褪去,即原因可能为NaClO的强氧化性褪色,故D错误;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
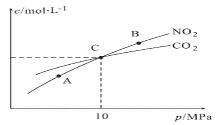
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,浓度均为1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z。充分反应后,X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成气体Z的浓度为0.4 mol·L-1。则该反应的化学方程式(Z用X、Y表示)是( )
A.X2(g)+2Y2(g) ![]() 2XY2(g)
2XY2(g)
B.2X2(g)+Y2(g) ![]() 2X2Y(g)
2X2Y(g)
C.X2(g)+3Y2(g) ![]() 2XY3(g)
2XY3(g)
D.3X2(g)+Y2(g) ![]() 2X3Y(g)
2X3Y(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物的水化物不能互相反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
① H2(g)+1/2O2(g)=H2O(l) ΔH=-285 kJ/mol
② H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③ C(s)+1/2O2(g)=CO(g) ΔH=-241.8 kJ/mol
④ C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是_______________。
(2)H2的燃烧热为____________________;C的燃烧热为__________________。
(3)燃烧10 g H2生成液态水,放出的热量为___________________。
(4)CO的燃烧热为_________________;其热化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.已知冰的熔化热为![]()
![]() ,冰中氢键键能为20
,冰中氢键键能为20![]() ,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中
,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中![]() 的氢键
的氢键
B.已知:![]() 石墨
石墨![]() ,
,![]()
![]() .
.![]() ,
,![]()
![]() .
.![]() 石墨
石墨![]() ,
,![]()
![]() .则
.则![]() ,
,![]()
![]()
C.实验测得环己烷![]() 、环己烯
、环己烯![]() 和苯
和苯![]() 的标准燃烧热分别为
的标准燃烧热分别为![]()
![]() 、
、![]()
![]() 和
和![]()
![]() ,可以证明在苯分子中不存在独立的碳碳双键
,可以证明在苯分子中不存在独立的碳碳双键
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为![]() ,
,![]() 若加入少量醋酸钠固体,则
若加入少量醋酸钠固体,则![]() 向左移动,
向左移动,![]() 减小,Ka变小
减小,Ka变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.W与X元素的单质在常温下不反应
B.X、Y、Z、W的原子半径依次减小
C.W的气态氢化物的沸点一定低于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com