
【题目】以下对核外电子运动状况的描述正确的是( )
A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
C.能层序数越大,s原子轨道的半径越大
D.在同一能级上运动的电子,其运动状态肯定不同
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物。下图是工业上利用锌焙砂制取金属锌的流程图。
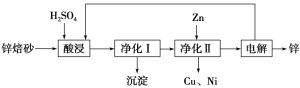
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式: _________________________________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe(OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是__________________________________。
(3)本流程中可以循环利用的物质除硫酸锌外还有__________________。
(4)若没有净化Ⅱ操作,则对锌的制备带来的影响是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在一100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
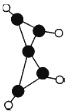
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和l,3-丁二烯类似,能与Br2发生l,2-加成和1,4-加成
D. 充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)__________________ ________。
(2)混合溶液中由水电离出的c(OH-)______0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________________mol·L-1,
c(OH-)-c(HA)=________________mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”);同温度下等浓度的下列四种盐溶液,按pH由大到小的顺序排列是__________________(填序号)。
A.NH4HCO3 B.NH4A
C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)计算:
(1)2mol Na2CO3的质量是 g。
(2)标准状况下11.2 L N2所含分子数是 个。
(3)将80gNaOH溶于水形成1L溶液,所得溶液中NaOH的物质的量浓度 mol/L。
(4)现有100 ml 1.00 mol/L NaCl溶液,所含NaCl固体的质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某些弱酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)物质的量浓度为0.1 mol·L-1的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是________(填编号)。
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是________。
A.c(H+) B. ![]()
C.c(H+)·c(OH-) D. ![]()
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数,理由是______________________________。
稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_____________________________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填准确数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com