
【题目】Q、W、X、Y、Z都是短周期主族元素,X、Y、Q在周期表中的位置关系如图所示,W、Z的最外层电子数相同,Z的核电荷数是W的2倍,则下列说法不正确的是( )
ⅠA | ⅡA | ⅢA | ⅣA |
Q | |||
X | Y |
A.非金属性:![]()
B.原子半径:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.最简单氢化物的稳定性:![]()
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美宇航局(NASA)提醒人类:环保、素食、节能将有效抑制温室效应;否则两极冰山融化,将引发一系列灾难。美国宇航局(NASA)科研人员发现了一种比二氧化碳高104倍的“超级温室气体”全氟丙烷(C3F8),提醒人们慎用含氟物。有关全氟丙烷的说法正确的是
A. 分子中的三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为: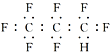
C. 由丙烷转化为全氟丙烷的反应为取代反应
D. 全氟丙烷可由全氟丙烯(CF2=CFCF3)与H2加成得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡萝卜中具有较多的胡萝卜素,它是人体主要营养之一,α-胡萝卜素的结构为: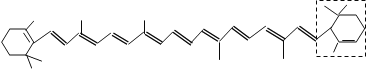 。有机化学中有时可以将结构简式中的C和H省略不写,如
。有机化学中有时可以将结构简式中的C和H省略不写,如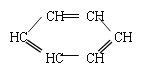 可写为:
可写为:![]() ;又如
;又如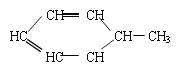 可写为:
可写为:![]() 。
。
(1)写出α-胡萝卜素的化学式______________。
(2)1mol胡萝卜素最多能与__________molBr2发生加成反应。
(3)β-胡萝卜素与α-胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳架结构相同,写出β-胡萝卜素虚线框内可能的结构简式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
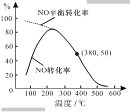
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
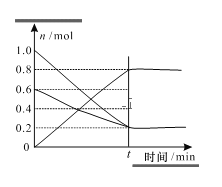
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com