
A.小于0.1 mol B.大于或等于0.1 mol,小于0.2 mol
C.一定等于0.2 mol D.大于0.2 mol,小于0.3 mol
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
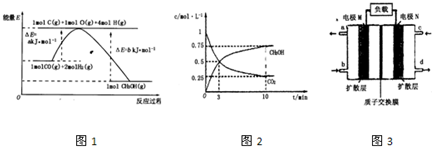
| 16 |
| 3 |
| 容器 | 容器1 | 容器2 | 容器3 |
| 反应物投入量(始态) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol?L-1 | c1 | c2 | c3 |
| 平衡时体系压强/Pa | p1 | p2 | p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
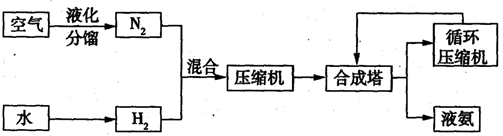
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
| ||
| 高温 |
| ||
| 高温 |
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com