
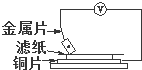
 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |


科目:高中化学 来源: 题型:
| A、溶液 | B、悬浊液 |
| C、胶体 | D、乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
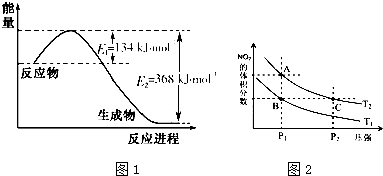 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
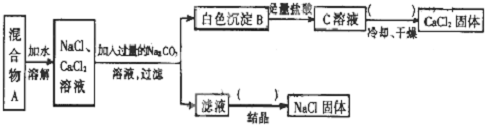
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+ |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L |
| D、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com