


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | ||||
| B、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-═CaCO2↓+CO32-+2H2O | ||||
C、用惰性电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、足量碳酸氢钠溶液与氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |

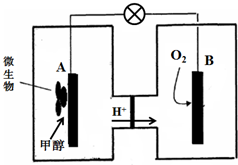
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
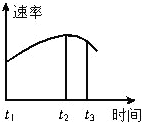 双鸭山市第一中学“化学兴趣小组”在重复教材实验时,将稀硫酸酸化的高锰酸钾溶液与草酸(即乙二酸--H2C2O4)混合反应的数据处理后,绘制图象如图所示.
双鸭山市第一中学“化学兴趣小组”在重复教材实验时,将稀硫酸酸化的高锰酸钾溶液与草酸(即乙二酸--H2C2O4)混合反应的数据处理后,绘制图象如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
| B、Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S)+I-=AgI(S)+Cl-能够发生 |
| C、氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| D、中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
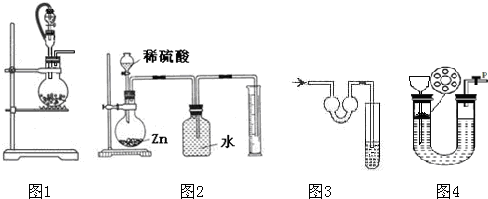
| A、用图1作为气体发生装置,液体由分液漏斗加入与烧瓶中与固体反应,产生的难溶于水的气体,用排水法测量气体体积时,排出的水的体积扣除分液漏斗加入的液体体积即为气体的体积 |
| B、用图2测量产生的H2体积时,如果气体滞留在烧瓶中,会导致所测得的氢气体积偏小 |
| C、图3尾气吸收装置适合于吸收易溶性气体,能防止倒吸 |
| D、图4可以“随开随用,随关随停”地用于一些难溶于水的气体的制备 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com