
【题目】室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
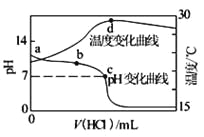
A. 氨水的电离程度a>b>c
B. a、d两点的溶液,水的离子积Kw(a)>Kw(d)
C. c点时消耗盐酸体积V(HCl)<20.00ml
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离吸热
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为_______,用化学式表示一种由B、C、E组成的物质_____。
(2)B的氢化物比E的氢化物的沸点____ (填“高”或“低”),理由是__________。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:

(1)甲烷燃料电池的负极反应式______.
(2)石墨电极(C)的电极反应式为______.
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______;丙装置中阴极析出铜的质量为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是______________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 向FeCl3溶液中加入铁粉:Fe3++Fe===2Fe2+
B. 向NaOH溶液中通入过量的CO2气体:OH﹣+CO2=== HCO3-
C. 铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D. AlC13溶液中加入足量的氨水:Al3++3OH﹣===Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是
A. 加热挥发HCl
B. 加水使平衡向正反应方向移动
C. 再通入氯气
D. 加CaCO3中和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A. -Y kJ·mol-1 B. -(5X-0.5Y)kJ·mol-1
C. -(10X-Y)kJ·mol-1 D. +(10X-Y)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com