
【题目】已知元素A的原子序数是53,请根据元素周期表的编排原则完成下列问题:
(1) A元素在周期表中的位置____。
(2) A的氢化物中含有化学键的类型____。(填共价键、离子键)
(3)与A同主族的元素形成的最高价氧化物的水化物中酸性或碱性最强的是______。(填化学式)
(4)写出A与H2反应的化学方程式_______
科目:高中化学 来源: 题型:
【题目】往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是
A. 温度升高Na2CO3溶液的Kw和c(H+)均会增大
B. CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)
C. CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
D. 沉淀转化的离子方程式为CO32(aq)+CaSO4(s)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.按要求完成下列问题:
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式____,其中一氯代物只有2种的结构简式为____。
(2)碳原子数是5的烷烃的同分异构体有_____种,其中含有甲基个数最多的结构简式为:______该物质的习惯命名为____。
(3)分子中含有26个电子的烷烃的二氯代物有_____种,其不含甲基的结构简式为:___。
(4)碳原子数小于10的烷烃中一氯代物只有一种结构的物质有_____种,其中含有碳原子个数最少的物质的电子式为:____。
请总结书写烷烃同分异构体的方法(至少两点)____
II.现有①CH4 ②C2H4 ③C6H6三种有机物:
(1)等质量的三种烃完全燃烧时生成水最多的是______;生成CO2最多的是______;消耗氧气最多的是______。(填序号,下同)
(2)同状况、同体积的三种烃完全燃烧时耗去O2的量最多的是______。
(3)在150℃、1.01×105 Pa下时,有两种烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
请总结书写烃的燃烧的规律(至少两点)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图

该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。

(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式____________________;名称是________________________。
表示的分子式____________________;名称是________________________。
(2) 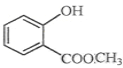 中含有的官能团的名称为_____________________________________。
中含有的官能团的名称为_____________________________________。
(3)丙基的两种结构简式为____________________、______________________。
(4)写出下列有机物的结构简式
2,2,3,3-四甲基戊烷_____________________________
3,4-二甲基-4-乙基庚烷______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
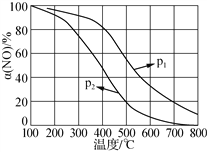
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
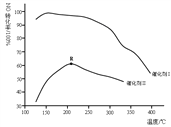
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com