
| 3+3 |
| 2 |
| 5+3 |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、其它条件不变,增大某一反应的质量,化学平衡一定向右移动 |
| B、对于有气体参加的反应,其它条件不变,增大压强,体积缩小,平衡一定移动 |
| C、对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的物质的量一定增加 |
| D、增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaNO3=Na++NO3- | ||
| B、Ba(OH)2=Ba2++OH- | ||
C、MgSO4═Mg+2+S
| ||
| D、H2SO4=H2++SO42- | ||
| E、H2SO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
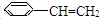 )5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空
)5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com