
| A. | 水泥 | B. | 钢铁 | C. | 陶瓷 | D. | 橡胶 |
科目:高中化学 来源: 题型:解答题
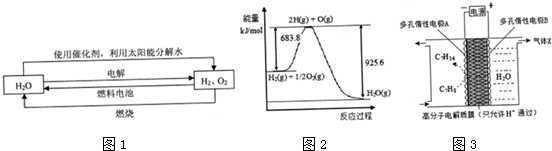
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA | |
| C. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA | |
| D. | 1 mol/L的盐酸溶液中含的离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
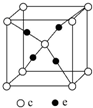 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
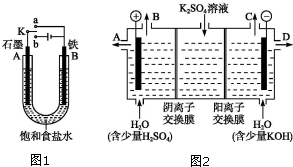 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 一定有Ag+ | D. | 可能有SO42-,也可能有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 17 | C. | 18 | D. | 15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com