
分析 (1)发生K2SO4+BaCl2═BaSO4↓+2KCl,产生沉淀23.3g,结合反应计算;
(2)发生H2SO4+2KOH═2H2O+K2SO4,溶质为K2SO4,溶质的质量分数=$\frac{溶质的质量}{溶液的质量}$×100%,以此来解答.
解答 解:(1)设混合物中K2SO4的质量为x,
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 23.3g
$\frac{174}{233}=\frac{x}{23.3g}$
解得x=17.4g,
答:该混合物中K2SO4的质量为17.4g;
(2)设生成K2SO4的质量为y,
H2SO4+2KOH═2H2O+K2SO4
112 174
23g-17.4g y
$\frac{112}{174}=\frac{23g-17.4g}{y}$,
解得y=8.7g,
反应后溶质K2SO4的质量=8.7g+17.4=26.1g,
反应后溶液的质量=23g+177g=200g,
所得K2SO4溶液中溶质的质量分数为$\frac{26.1g}{200g}$×100%=13.05%,
答:所得K2SO4溶液中溶质的质量分数为13.05%.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、质量关系为解答的关键,侧重分析与计算能力的考查,注意溶质为硫酸钾,题目难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
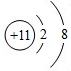
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
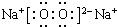 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.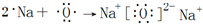 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
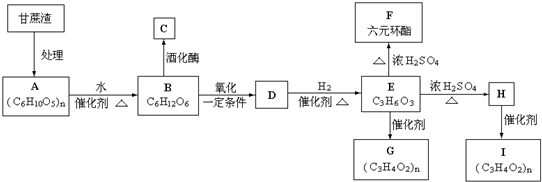
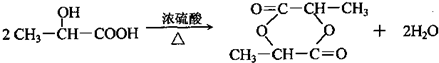


 上四 个碳原子各连接1个支链或取代基.
上四 个碳原子各连接1个支链或取代基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com