
(1)向10 mL 1 mol·L-1的H3PO4中逐滴加入6 mL 1 mol·L-1的Ba(OH)2溶液,边加边振荡,有什么现象发生?并求生成的盐的物质的量。?
(2)如图8-1的图象是H3PO4溶液与Ba(OH)2溶液反应,生成沉淀的量与消耗H3PO4的物质的量的关系,试分析:?
a.试剂加入的方法;?
b.各段曲线的含义;?
c.若D=1时,x1、x2的值。?????

图8-1
提示:向H3PO4滴加Ba(OH)2,开始时,H3PO4是远远过量的,则生成酸式盐Ba(H2PO4)2(易溶),所以无现象。随着碱量的增多,逐渐生成了BaHPO4,开始出现白色沉淀。
(1)Ba(H2PO4)2为4×10-3mol;BaHPO4为2×10-3mol。?
2H3PO4 + Ba(OH)2![]() Ba(H2PO4)2+2H2O ①?
Ba(H2PO4)2+2H2O ①?
1 0.5?
H3PO4 + Ba(OH)2![]() BaHPO4+2H2O ②?
BaHPO4+2H2O ②?
1 1?
2H3PO4+3Ba(OH)2![]() Ba3(PO4)2+6H2O ③?
Ba3(PO4)2+6H2O ③?
1 1.5?
因为H3PO4为10×10-3×1=10-2mol Ba(OH)2为6×10-3×1=6×10-3mol,?
所以两者之比为1∶0.6,介于①②之间,反应生成盐为Ba(H2PO4)2和BaHPO4。其中Ba(H2PO4)2为4×10-3mol;BaHPO4为2×10-3mol。?
(2)a.从图象中可看出是向Ba(OH)2溶液中滴加磷酸。?
b.AC段:反应开始时,生成Ba3(PO4)2沉淀逐渐增多,到B点时Ba(OH)2完全转化为Ba3(PO4)2。
BC段:Ba3(PO4)2与H3PO4产生BaHPO4沉淀,沉淀迅速增加,至C点时,全部为BaHPO4。此时沉淀达最大量。?
CD段:BaHPO4与H3PO4反应生成Ba(H2PO4)2而溶解,使沉淀量减少,至D点恰好完全溶解,溶质为Ba(H2PO4)2。?
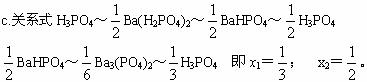


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2011-2012学年沈阳铁路实验中学高二上学期期末考试化学试卷 题型:填空题
(14分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 m ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
| A.溶液pH=7 | B.水的离子积KW=c2(OH-) | C.V=10 | D.c(K+)<c( Na+) Na+) |
 Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期中考试化学试卷(解析版) 题型:填空题
草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A.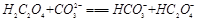
B.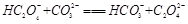
C.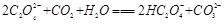
D.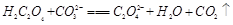
(3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届北京市海淀区高三上学期期中考试化学试卷(解析版) 题型:实验题
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方
程式为 。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待
固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论 。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体, (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是 。
a.装置Ⅰ的气球体积较大 b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算 d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
|
实验方案 |
预测现象 |
预测依据 |
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色 沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应 (写离子方程式)。 |
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色 沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与
CaCl2溶液反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省天水市高三第四阶段考试化学试卷 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)= 0时,c(H+)=1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)= 2 c(C2O42-)+ c(HC2O4-)
C.V(NaOH)= 10 mL时,c(H+)=1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com