
| A. | 苯中加溴水振荡,溴水层褪色 | |
| B. | 乙烯通入溴水,溴水褪色 | |
| C. | 石油裂解后的气体通入溴水,溴水褪色 | |
| D. | 苯转化为环己烷 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 形成简单离子的离子半径为D>C>A | |
| B. | 四种元素形成的简单氢化物中,D的沸点最高 | |
| C. | B的氧化物对应水化物为弱酸,C和D的氧化物对应水化物均为强酸 | |
| D. | C和D形成的某种化合物具有8电子稳定结构,其化学式可能是C2D2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酚酞试液 | B. | 用石蕊溶液 | ||
| C. | NaOH溶液 | D. | 用硝酸酸化后的AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 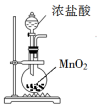 用装置制取氯气 | B. | 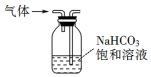 用装置除去CO2中的少量SO2气体 | ||
| C. | 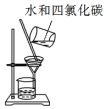 用装置分离水和四氯化碳的混合物 | D. | 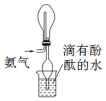 用装置收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的硫化钠溶液中:c(Na+)=2c(S2-)+c(HS-)+c(H2S) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH后:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 物质的量浓度相等的CH3COOH和NaOH溶液等体积混合后:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
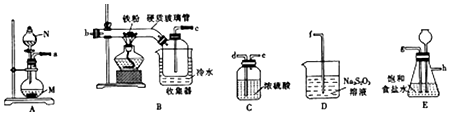
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
| 实验Ⅱ(取褪色后溶液同浓度的FeCi3溶液) | 滴加2KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com