
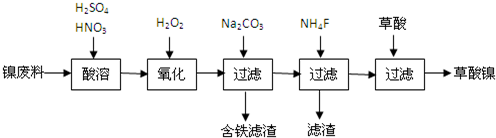

分析 (1)根据过滤装置答题;
(2)过氧化氢氧化亚铁离子为铁离子,依据电荷守恒和原子守恒,加入Na2CO3溶液调pH至4.0〜4.5,促进铁离子水解形成氢氧化铁沉淀;氟化钙、氟化镁难溶于水;
(3)①实验中,观察到无水硫酸铜变蓝,说明产物有水,洗气瓶中内澄清石灰水变浑浊,说明产物有二氧化碳,在干燥管尖嘴处点燃逸出的气体,烧杯内壁附有的澄清石灰水变浑浊,说明产物中有一氧化碳;E装置中将内壁附有的澄清石灰水的烧杯换成干燥的烧杯,就可以检验产物中有没有氢气;
②根据验证产物相互之间不能干扰可以设计装置连接顺序.
解答 解:(1)过滤操作中用到铁架台、烧杯、玻璃棒、漏斗、滤纸,故答案为:漏斗、滤纸;
(2)加双氧水的目的是把Fe2+氧化生成Fe3+,加入碳酸钠溶液的作用是中和过多的H+,调节pH,促进铁离子水解沉淀完全,再加入NH4F的目的是除去钙离子、镁离子,使最后加草酸时生成草酸镍沉淀;
故答案为:调节pH,促进铁离子水解沉淀完全;除去Ca2+、Mg2+;
(3)①实验中,观察到无水硫酸铜变蓝,说明产物有水,洗气瓶中内澄清石灰水变浑浊,说明产物有二氧化碳,在干燥管尖嘴处点燃逸出的气体,烧杯内壁附有的澄清石灰水变浑浊,说明产物中有一氧化碳,E装置中将内壁附有的澄清石灰水的烧杯换成干燥的冷烧杯,罩在火焰上方,内壁无现象,证明气体中无氢气,
故答案为:H2O、CO、CO2;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明气体中无氢气;
②草酸在157℃时开始升华,189.5℃分解,所以加热后的草酸蒸汽,防止草酸对CO2的检验造成干扰,要先除去草酸,产物中有H2O、CO、CO2,水要首先检验,以防止后面溶液中的水对它的干扰,然后检验并除去二氧化碳,最后再检验一氧化碳,所以连接顺序为ADCBE,C装置的作用是检验产物中是否有水,
故答案为:ADCBE;检验产物中是否有水.
点评 本题考查了流程分析推断,实验操作步骤的分析判断,实验方案的设计等,题目综合性较大,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.1mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.6 | 2.1 |
| 完全沉淀时 | 5.2 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 神舟飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类相同 | |
| C. | c(OH-)前者大于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将块状药品研细后再反应 | |
| B. | 食物储存在冰箱里 | |
| C. | 用MnO2作H2O2分解反应的催化剂 | |
| D. | 用30% H2SO4溶液代替5% H2SO4溶液与锌粒反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com