
����Ŀ������˵����ȷ���ǣ� ��
A. ��Ksp��AgCl��=1.77��10��10��Ksp��Ag2CrO4��=2.0��10��12������֪AgCl�ܽ�ȱ�Ag2CrO4���ܽ�ȴ�
B. ����ˮ��ʱ��������̼������Һ���ݣ��������ܽ�
C. ��̼�ᱵ�����м���ϡ���ᣬ��������ת��������֪���ᱵ��Ksp��̼�ᱵ�Ĵ�
D. AgCl��10 mL 0.1 mol/L��KCl��Һ���ܽ����������10 mL0.05mol/L��AgNO3��Һ�ж�
���𰸡�B
��������
A�������ܶȻ������㱥����Һ��AgCl��Ag2CrO4���ʵ���Ũ�ȣ�
B��ˮ���е�������������ܽ��С��ת����̼��ƺ������ᷴӦ�������ܵ��Ȼ��ơ�
C����̼�ᱵ�����м���ϡ���ᣬBaCO3ת��ΪBaSO4��
D����Ksp��AgCl��=a������Ksp��AgCl��=c��Ag������c��Cl��������KCl��Һ��c��Ag������AgNO3��Һ��c��Cl����������n=cV����n��AgCl����
A�������Ȼ�����Һc��AgCl��=xmol��L��1����x��x=1.77��10-10����ã�x��1.33��10-5��������Һ��c��Ag2CrO4��=ymol��L��1����2y��2��y=1.12��10-12�����y=![]() =6.54��10-5����Ag2CrO4���ܽ�ȴ�A����
=6.54��10-5����Ag2CrO4���ܽ�ȴ�A����
B��ˮ���е�������������ܽ��С����̼������Һ���ݺ�ת����̼��ƣ�̼��ƿ������ᷴӦ�������ܵ��Ȼ��ƣ���B��ȷ��
C����̼�ᱵ�����м���ϡ���ᣬBaCO3ת��ΪBaSO4��̼�ᱵ���ܶȻ�Ksp=c(Ba2��)c(CO32��)�����ᱵ���ܶȻ�Ksp=c(Ba2��)c(SO42��)�����ᱵ��Ksp��̼�ᱵ��С����C����
D����Ksp��AgCl��=a����0.1mol��L-1��KCl��Һ��c��Ag����=![]() mol��L��1=10amol��L��1����10mL��Һ�����ܽ���Ȼ���n��AgCl��=0.01L��10amol��L��1=0.1amol��0.05mol��L-1��AgNO3��Һ��c��Cl����=
mol��L��1=10amol��L��1����10mL��Һ�����ܽ���Ȼ���n��AgCl��=0.01L��10amol��L��1=0.1amol��0.05mol��L-1��AgNO3��Һ��c��Cl����=![]() mol��L��1=20amol��L��1����10mL��������Һ�����ܽ��Ȼ���n��AgCl��=0.01L��20amol��L��1=0.2amol��ǰ���ܽ�����٣���D����
mol��L��1=20amol��L��1����10mL��������Һ�����ܽ��Ȼ���n��AgCl��=0.01L��20amol��L��1=0.2amol��ǰ���ܽ�����٣���D����
��ѡ��B��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2![]() 2NO+O2���ܱ�������Ӧ���ﵽƽ��״̬�ı�־�ǣ���
2NO+O2���ܱ�������Ӧ���ﵽƽ��״̬�ı�־�ǣ���
��1����λʱ��������n mol O2��ͬʱ����2n mol NO2
��2����λʱ��������n mol O2��ͬʱ����2n mol NO
��3����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ��Ӧ���ʵı�Ϊ2:2:1��״̬
��4������������ɫ���ٸı��״̬
��5����������ƽ����Է����������ٸı��״̬��
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ����������أ��������������ʵ�Ľ�����ȷ���ǣ� ��
�������ʵ | ���� | |
A | ���ȵĴ�����Һȥ���� | Na2CO3��ֱ�������۷�Ӧ |
B | Ư���ڿ����о��ñ��� | Ư���е�CaCl2������е�CO2��Ӧ����CaCO3 |
C | ʩ��ʱ����ľ�ң���Ҫ�ɷ�K2CO3��������NH4Cl���ʹ�� | K2CO3��NH4Cl�ڳ�ʪ�������лᷴӦ���ɰ��������ͷ�Ч |
D | FeCl3��Һ������ͭ��ӡˢ��·������ | Cu�ܴ�FeCl3��Һ�а�����ԭΪ����̬ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ��Һ�п��ܴ���Na+��Al3+��Fe2+��NH4+��NO3����CO32����SO42���еļ������ӣ��Ҵ��ڵĸ����Ӿ�����ͬ�����ʵ�����ijͬѧ�Ը���Һ��������ʵ�飺

�����ж���ȷ����
A.����Aһ����CO2������Bһ����NH3
B.��ɫ������������Al(OH)3
C.��Һ��һ������Al3+��Fe2+��NO3����NH4+
D.��Һ��һ�������ڴ���Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҷ��ֶ�ұ�����е�⾫���ᴿ�ɽ��ߴ����Ʊ��ɱ�����ص���װ����ͼ��ʾ����Cu-Si�Ͻ�����Դ����950����������Һ���ν��е�⾫���� ����˵����ȷ����
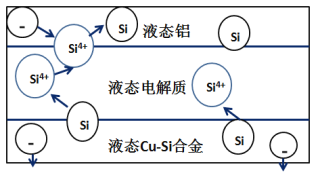
A.������Һ̬Cu-Si�Ͻ�����������Һ̬���缫
B.����Һ���ε�������ʹ�����ܹ����������������
C.�ڸ�Һ��������Cu������Si��������Si4+������Cu2+����ԭ
D.Һ̬���缫�븺����������Ϊ���ص�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����е������ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�(��֪���ԭ�Ӱ뾶Ϊ0.089nm)��
Ԫ�ش��� | A | B | C | D | E |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
��Ҫ���ϼ� | ��2 | ��3 | ��6����2 | ��1 | ��2 |
(1)�Ƚ�A��B��E����Ԫ�صļ����ӵ����Ӱ뾶��С___(�ö�ӦԪ�����ӷ��ű�ʾ)��
(2)AԪ�ؼ����ӵĽṹʾ��ͼΪ__��BԪ��λ�����ڱ��е�__����__�塣
(3)B������������Ӧˮ������C������������Ӧˮ���ﷴӦ�����ӷ���ʽΪ__��
(4)��������Ԫ�ص�����������Ӧˮ������������ǿ����__(�ѧʽ)��
(5)C��E�γɵĻ�����Ϊ__(�ѧʽ)��
(6)�õ���ʽ��ʾA��D�γɻ�����Ĺ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϣ�ж�����ȼ������ˮʱ�������仯������˵����ȷ���ǣ� ��
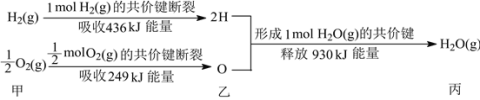
A.H2(g)��O2(g)��Ӧ����1molH2O(g)ʱ�ų�����930kJ
B.H2O(g)�ֽ�ΪH2(g)��O2(g)ʱ�ų�����
C.ͼ�мס��ҡ��������������е���������С��ϵΪ����>��>��
D.1molH2(g)��![]() molO2(g)����������1molH2O(g)������
molO2(g)����������1molH2O(g)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ͼ���ܱ�ʾ����ķ��ӽṹ����Ҫ��ش��������⣺

(1)������ʵ��֤�������������������ṹ��������ƽ��ṹ��֤����___��
a��CH3Clֻ��һ�ֽṹ
b��CH2Cl2ֻ��һ�ֽṹ
c��CHCl3ֻ��һ�ֽṹ
d��CCl4ֻ��һ�ֽṹ
(2)1molCH4��__mol���õ��Ӷԣ�1molij������CnH2n+2)����__mol���õ��Ӷԡ�
(3)![]() �й����ԭ�������__����
�й����ԭ�������__����
(4)ij������Է�������Ϊ58������ȴ�����__�֡�
(5)��CH4��C2H6��C3H8��C4H10��������Ϊ1g��������O2��ȼ�գ�����O2������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���᳦��ҩ����Ч�ɷֵĺϳ�·����ͼ(���ַ�Ӧ��ȥ�Լ�������)��
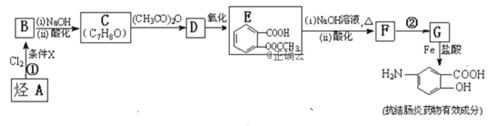
��֪��a. ![]()
![]()
![]()
b. ![]()
![]()
![]()
����������Ϣ�ش��������⣺
(1)��A�Ľṹ��ʽ��__________��
(2)�ٵķ�Ӧ������__________���ڵķ�Ӧ������____________��
(3)���жԿ��᳦��ҩ����Ч�ɷֿ��ܾ��е������Ʋ���ȷ����__________��
A.ˮ���Աȱ��Ӻã��ܶȱȱ��ӵĴ� B.�ܷ�����ȥ��Ӧ
C.�ܷ����ۺϷ�Ӧ D.�����������м���
(4)E������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��________________________________.
(5)��������������E��ͬ���칹����________________�֣����к˴Ź�������������壬�����֮��3��1��1��1���칹��Ľṹ��ʽΪ___________________��
a.��E������ͬ�Ĺ�����
b.�����ϵ�һ����ȡ������������
(6)��֪![]() �ױ��������������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ������AΪԭ���Ʊ��߷��ӻ�����
�ױ��������������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ���ݴ������AΪԭ���Ʊ��߷��ӻ����� �ĺϳ�·��______��(���Լ���ѡ)
�ĺϳ�·��______��(���Լ���ѡ)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com