
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:分析 (1)2p能级3个电子分别单独优先占据一个轨道;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第四周期,根据洪特规则特例书写价层电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(3)N2F2分子结构式为F-N=N-F;
(4)F元素电负性比H大,NF3中N周围电子密度减小,成键电子对之间的排斥力较小,因而键角较小;
(5)NH4BF4 中铵根离子中含有1个配位键,B原子与F之间形成1个配位键;
(6)①原子总数相同、价电子总数相同的分子或离子互为等电子体;
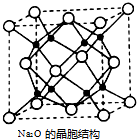
②由均摊法可知晶胞中白色球数目为4、黑色球数目为8,Na原子与氧原子数目之比为2:1,则白色球为氧原子、黑色球为Na原子,黑色球配位数为4,则白色球配位数为8,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)2p能级3个电子分别单独优先占据一个轨道,符合洪特规则;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第四周期,由洪特规则特例可知价层电子排布式为3d54s1,
故答案为:洪特规则;3d54s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
(3)N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键,
故答案为:sp2杂化;3;
(4)F元素电负性比H大,F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,成键电子对之间的排斥力较小,因而NF3的键角<NH3的键角,
故答案为:<;F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度;
(5)NH4BF4 中铵根离子中含有1个配位键,B原子与F之间形成1个配位键,l mol NH4BF4 含有2mol配位键,
故答案为:2;
(6)①与N3-互为等电子体的分子或离子为CO2、CNO-等,
故答案为:CO2、CNO-;
②晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、黑色球数目为8,Na原子与氧原子数目之比为2:1,则白色球为氧原子、黑色球为Na原子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×$\frac{62}{6.02×1{0}^{23}}$g,则晶胞密度为4×$\frac{62}{6.02×1{0}^{23}}$g÷(566×10-10 cm)3=$\frac{4×62}{6.02×2{0}^{23}×(566×1{0}^{-10})^{3}}$g•cm-3,
故答案为:8;$\frac{4×62}{6.02×2{0}^{23}×(566×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式判断、配位键、价层电子对数互斥理论、等电子体、晶胞结构与计算等,(4)中键角判断为易错点、难点,注意同周期第一电离能异常情况.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 时间/浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A. | 第4min、第8min时分别达到化学平衡,且平衡常数相同 | |
| B. | 反应在第2min时改变了某一条件,该条件一定是升高温度 | |
| C. | 反应在第2min到第4min时,O2的平均速率为0.1875mol•min-1 | |
| D. | 在开始反应的前2min内,该反应放出0.2QKJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在浓硫酸加热140℃条件下反应 | |
| B. | 乙醇与乙酸反应制乙酸乙酯 | |
| C. | 石油裂解制丙烯 | |
| D. | 氯乙烷在氢氧化钠水溶液中加热生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 鉴别己烯和苯:分别向己烯和苯中滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 检验卤代烃中的卤素原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
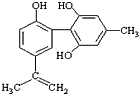 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| B. | 1mol该物质分别与浓溴水和H2反应时最多消耗溴水和H2分别为4mol和7mol | |
| C. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池充电时,阴极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O | |
| C. | 电池充电过程中,阴极附近溶液的pH升高 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
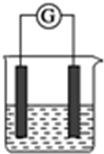 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com