
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质﹣﹣碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是( )
|
| A. | 可以用浓盐酸调节K2Cr2O7溶液的酸性 |
|
| B. | 该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
|
| C. | 若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
|
| D. | 可以通过过滤的方法最终得到碳纳米管 |
| 氧化还原反应;原电池和电解池的工作原理. | |
| 专题: | 氧化还原反应专题. |
| 分析: | 由信息可知,发生C+K2CrO7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O,C元素的化合价升高,Cr元素的化合价降低,以此来解答. |
| 解答: | 解:A.浓盐酸与K2Cr2O7发生氧化还原反应,不能用浓盐酸调节K2Cr2O7溶液的酸性,故A错误; B.C元素的化合价升高,失去电子被氧化,则每氧化2 mol碳纳米颗粒,转移2mol×(4﹣0)×=NA8NA个电子,故B正确; C.若将该反应设计为原电池,C失去电子,碳纳米颗粒应作为原电池的负极,故C错误; D.碳纳米管的直径较小,可透过滤纸,不能利用过滤分离,故D错误; 故选B. |
| 点评: | 本题考查氧化还原反应,为高频考点,把握习题中的信息判断发生的反应、反应中元素的化合价变化为解答的关键,涉及电子转移、原电池原理、混合物分离方法等,综合性较强,侧重分析与迁移应用能力的考查,题目难度中等. |


科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1 mol·L-1的是( )
A.将40 g NaOH溶解在1 L水中
B. 将22.4 L HCl气体溶于水配成1 L溶液
将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B.常温下,用蒸馏水不断稀释醋酸,溶液中c(CH3COO-)/c(CH3COOH)的值变小
C.反应SiO2(s)+ 3C(s) = SiC(s) + 2CO(g)室温下不能自发进行,则该反应的△H<0
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X,Y,Z均为短周期元素,X,Y处于同一周期,X,Z的最低价离子分别为X2﹣和Z﹣,Y+和Z﹣具有相同的电子层结构.下列说法正确的是( )
|
| A. | 原子最外层电子数:X>Y>Z | B. | 单质沸点:X>Y>Z |
|
| C. | 离子半径:X2﹣>Y+>Z﹣ | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化热是指一定条件下,1mol不饱和化合物加氢时放出的热量.表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据:
)和苯的氢化热数据:
| 物质 |
|
|
|
| 氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
根据表中数据推断正确的是( )
|
| A. | 环己二烯与H2的反应最剧烈 |
|
| B. | 环己烯、环己二烯和苯有相同的官能团 |
|
| C. | 三种化合物中环己二烯的稳定性最强 |
|
| D. | 上述条件下,1 mo |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.
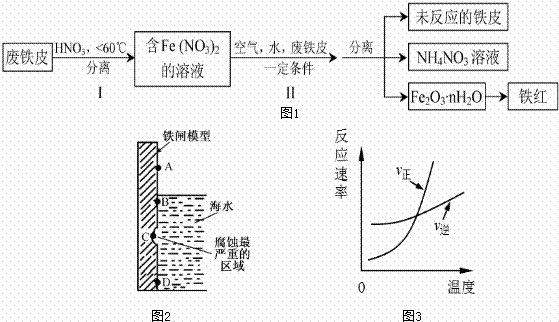
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
________________________________________________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是
________________________________________________________________________。
(4)晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)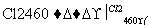 SiCl4
SiCl4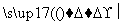 SiCl4(纯)
SiCl4(纯)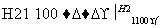 Si(纯)
Si(纯)
写出SiCl4的电子式________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式________________________________________________________________________________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为11。写出该反应的化学方程式____________________________ ____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO可用于合 成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。
成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com