
| A、1 molCO2为22.4L |
| B、标准状况下,1mol水体积为22.4L |
| C、相同状况下,1molH2和O2所占体积相同 |
| D、只有在标准状况下气体摩尔体积才是22.4mol/L |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| A、0.1 mol.L-1 |
| B、0.2mol.L-1 |
| C、0.4mol.L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.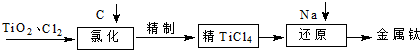
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔 | B、丙炔 |
| C、2-戊炔 | D、1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3能与NaOH溶液反应,则Al(OH)3也能与氨水反应 |
| B、过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂 |
| C、Fe(OH)3溶于氢碘酸的离子方程式为Fe(OH)3+3H+═Fe3++3H2O |
| D、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com