
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
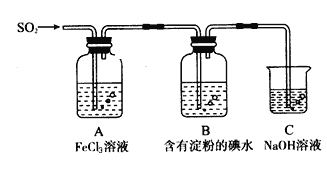
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________ 才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应_____________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
【答案】BD0.5过滤BE取反应后A中试液少许,加入KSCN溶液,不变红,再加入新制的氯水,溶液变红(或取反应后A中试液少许,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀)B中溶液的蓝色褪去SO2+I2+2H2O=SO42-+2I-+4H+
【解析】
(1)A.硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B.浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,故B正确;C.固体硫在纯氧中燃烧,操作不容易控制,故C错误;D.Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,故D正确;故选BD;
CuSO4+SO2↑+2H2O,故D正确;故选BD;
(2)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫;如果有560mL SO2气体(已折算为标态),其物质的量为0.56L÷22.4L/mol=0.025mol,进入C装置中发生反应为SO2+NaOH=NaHSO3,则C中消耗氢氧化钠物质的量为0.025mol,50mL NaOH溶液的浓度至少为0.025mol÷0.05L =0.5mol/L;
(3)通过加热浓缩、冷却结晶、过滤、洗涤、自然干燥等操作即可从A中所得溶液提取晶体;蒸发使用仪器有:蒸发皿、玻璃棒;过滤使用仪器有:漏斗、烧杯、玻璃棒;没有用到的仪器是分液漏斗和冷凝管,故答案为:BE;
(4)取反应后A中试液少许,加入KSCN溶液,不变红,说明溶液里不含Fe3+,再加入新制的氯水,溶液变红,可知反应的A溶液中含有Fe2+,即可证明SO2与Fe3+发生了氧化还原反应(或取反应后A中试液少许,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀,证明溶液中含有硫酸根,即可证明SO2与Fe3+发生了氧化还原反应);
(5) B中溶液的蓝色褪去,I2+SO2+2H2O=2HI+H2SO4,则二氧化硫能使含有碘的淀粉溶液褪色,即说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,发生反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+。


科目:高中化学 来源: 题型:
【题目】2007年下半年,我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
A.“西气东输”中的天然气的主要成分为甲烷
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是
A. 手机上用的锂离子电池属于二次电池
B. 燃烧植物的秸秆和枝叶以获取热量和肥料属于生物质能的利用方式
C. 所有的氧化还原反应都可以设计成原电池
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于电解质且能导电的是( )
①氯化铜溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融氢氧化钾 ⑥稀硫酸 ⑦酒精
A. ⑤B. ①②⑥C. ②⑤⑥⑦D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国利用合成气直接制烯烃获重大突破,其原理是
反应①:C(s)+1/2O2(g)=CO(g) ΔH1
反应②:C(s)+H2O(g)=CO(g)+H2(g) ΔH2
反应③:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.1 kJ·mol-1
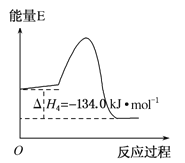
反应④:2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH4,能量变化如图所示
反应⑤:3CH3OH(g)→CH3CH=CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
下列说法正确的是( )
A. 反应③使用催化剂,ΔH3减小 B. ΔH1-ΔH2<0
C. 反应④中正反应的活化能大于逆反应的活化能 D. 3CO(g)+6H2(g)→CH3CH=CH2(g)+3H2O(g) ΔH=-121.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com