
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数之和为14。
(1)XW4的空间构型为____,HWO的结构式为____,Z在元素周期表中的位置是____。
(2)①X、Y、Z、W原子半径由大到小依次是____(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是_________。(填化学式)。
(3)W同族上一周期元素单质不能把W元素从其钠盐的水溶液中置换出来,用化学方程式解释____________________。
(4)①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为________________。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式_________。
(5)NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为____。若取该液体滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如下图,已知沉淀2为蓝色。
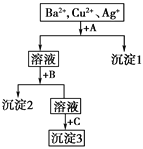
(1)写出沉淀的化学式:沉淀1______;沉淀3________。
(2)写出混合液+A的离子方程式_________________,溶液+B的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HF 和HCN 都是一元弱酸,但Ka(HF)>Ka(HCN)。现有100mL0.1mol/L 的NaF 溶液(代号“甲”)和100mL 0.1mol/L 的NaCN 溶液(代号“乙”),下列有关甲、乙两种溶液的说法中不正确的是( )
A. 溶液pH:甲<乙 B. 溶液中弱酸分子浓度:c(HF)>c(HCN)
C. 甲溶液中:c(HF)=c(OH-)-c(H+) D. 乙溶液中: c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
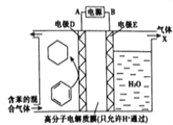
A. 气体X是氢气,电极E是阴极
B. H+由左室进入右室,发生还原反应
C. 该储氢过程就是C6H6与氢气反应过程
D. 电极D的电极反应式为C6H6+6H++6e-=C6H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________(填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是![]()
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
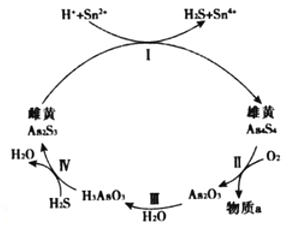
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________。
②Ⅰ中反应的离子方程式是____________________________________。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________(列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________。
②“置换”时生成单质铋的离子方程式为____________________________________。
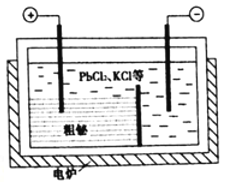
③“粗秘”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体吸收。
(1)在人体中进行Fe2+![]() Fe3+的转化时,②中的Fe3+作_______剂。
Fe3+的转化时,②中的Fe3+作_______剂。
(2)“服用维生素C,可使食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中做_____剂,具有_______性。
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属具有的通性是( )
①具有良好的导电性②具有良好的传热性③具有延展性④都具有较高的熔点⑤通常状下都是固体⑥都具有很大的硬度
A. ①②③ B. ②④⑥ C. ④⑤⑥ D. ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com