
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.002mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中0族元素的电负性最大 | |
| C. | ⅠA族元素的原子,其半径越大第一电离能越小 | |
| D. | 所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
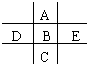 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高正价是最低负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: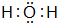 .
.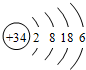 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com