
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
分析 A、元素种类由质子数决定;
B、核电荷数=质子数=核外电子数;
C、依据原子电子排布规律分析判断;
D、质量数=质子数+中子数分析计算.
解答 解:A、三种同位素12C、13C、14C的原子质子数相同,属于同种元素,故A错误;
B、三种同位素12C、13C、14C的原子的核电荷数都是6,故B错误;
C、三种同位素12C、13C、14C的原子核电荷数为6,电子排布均为2、4结构,电子层数均为2,故C错误;
D、三种同位素12C、13C、14C的原子中中子数=质量数-质子数,分别为12-6=6;13-6=7;14-6=8;所以对三种原子均不同,故D正确,故选D.
点评 本题考查了同位素原子的中子数、质子数、电子数等的定量计算,原子排布规律,元素种类的决定因素.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T2O与D2O | B. | 4019K与4020Ca | ||
| C. | O2和O3 | D. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 | |
| B. | 1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 | |
| C. | 1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 | |
| D. | 1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 单质活泼性:X>Y>Z | ||
| C. | 原子序数:X>Y>Z | D. | 离子半径:X2->Y+>Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA | |
| B. | 6.2gNa2O和7.8gNa2O2混合物中所含有的阴离子数为0.3 NA | |
| C. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023 | |
| D. | 18g D2O(重水)完全电解,转移6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
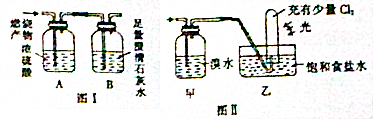
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com