
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、胆矾、漂白粉、苛性钠、氨水、乙醇 |
| B、水玻璃、硫酸、胆矾、次氯酸、乙醇 |
| C、苛性钠、胆矾、乙醇、次氯酸、漂白粉 |
| D、乙醇、漂白粉、胆矾、氢氧化铜、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28.6% |
| B、42.6% |
| C、41.2% |
| D、57.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:| C(H2)C(CO) |
| C(H2O) |
| t/K | 300 | 400 | 500 | … |
| K/(mol?L-1)2 | 4×106 | 8×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

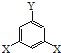 通式表示(其中X、Y均不为氢),现有以下四种物质既符合上述通式又能发生银镜反应,其中在核磁共振氢谱图上能产生4个吸收峰的是
通式表示(其中X、Y均不为氢),现有以下四种物质既符合上述通式又能发生银镜反应,其中在核磁共振氢谱图上能产生4个吸收峰的是
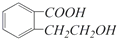 它可通过不同的反应分别得到下列物质:
它可通过不同的反应分别得到下列物质:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 试剂或方法 |
| 鉴别MgCl2和AlCl3 | |
| 证明NaCl中含有Na2SO4 | |
| 证明CaO粉末中含有铝粉 | |
| 除去NaCO3溶液中少量NaHCO3 | |
| 除去Na2CO3固体中少量的NaHCO3 | |
| 证明纯碱溶液显碱性 | |
| 检验酒精中是否含有水 | |
| 检验氯化亚铁是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 | 用CCl4萃取 溴水中的溴 | 从NaCl与I2的混合物中回收I2 | 制备与收集二氧化硫 | 制备乙酸丁酯 |
| 装置 | 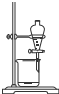 | 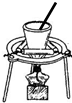 | 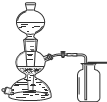 | 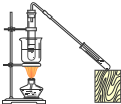 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com