
¹¤ŅµÉĻÓƵē½ā±„ŗĶNaClČÜŅŗµÄ·½·ØĄ“ÖĘČ”NaOH”¢Cl2ŗĶH2£¬²¢ŅŌĖüĆĒĪŖŌĮĻÉś²śŅ»ĻµĮŠ»Æ¹¤²śĘ·£¬³ĘĪŖĀČ¼ī¹¤Ņµ”£
£Ø1£©Čō²ÉÓĆĪŽøōĤ·Øµē½āĄäµÄŹ³ŃĪĖ®Ź±£¬Cl2»įÓėNaOH³ä·Ö½Ó“„£¬µ¼ÖĀ²śĪļ½öŹĒNaClOŗĶH2”£ĪŽøōĤ·Øµē½āĄäµÄŹ³ŃĪĖ®ĻąÓ¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø2£©ĀČ¼ī¹¤ŅµŗÄÄÜøߣ¬Ņ»ÖÖ½«µē½ā³ŲÓėČ¼ĮĻµē³ŲĻą×éŗĻµÄŠĀ¹¤ŅÕæÉŅŌ½Ś£Øµē£©ÄÜ30£„ŅŌÉĻ”£ŌŚÕāÖÖ¹¤ŅÕÉč¼ĘÖŠ£¬Ļą¹ŲĪļĮĻµÄ“«ŹäÓė×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬ĘäÖŠµÄµē¼«Ī“±ź³ö£¬ĖłÓƵĥė×ÓĤ¶¼Ö»ŌŹŠķŃōĄė×ÓĶعż”£
¢Ł¾¾«Öʵı„ŗĶNaClČÜŅŗÓ¦“ÓĶ¼ÖŠµē½ā³ŲµÄ £ØĢīŠ“”°×ó”± »ņ”°ÓŅ”±£©³Ų×¢Čė”£
¢ŚĶ¼ÖŠXŹĒ____ __£ØĢī»ÆѧŹ½£©£»ŅŅÖŠÓŅŹŅµÄµē¼«·“Ó¦Ź½ĪŖ£ŗ _ £¬Ķ¼Ź¾ÖŠĒāŃõ»ÆÄĘČÜŅŗÖŹĮæ·ÖŹża£„Óėb£„µÄ¹ŲĻµŹĒ £ØĢī×ÖÄø£©”£
A. a%=b% B. a%©b% C. a%©b%
¢Ū¼×ÖŠµÄĄė×Ó½»»»Ä¤ĪŖ £ØĢī”°ŃōĄė×Ó½»»»Ä¤”±»ņ”°ŅõĄė×Ó½»»»Ä¤”±£©”£
£Ø3£©ĀČ¼ī¹¤ŅµµÄ²śĪļNaOHÓė²»Ķ¬ĪļÖŹ·“Ó¦æÉŅŌÉś³É²»Ķ¬µÄŃĪ”£ŅŃÖŖ³£ĪĀĻĀ£¬ÅØ¶Č¾łĪŖ0.1 mol/LµÄ4ÖÖÄĘŃĪČÜŅŗpHČēĻĀ±ķ£ŗ
| ČÜÖŹ | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
£Ø1£©Cl££«H2O£½ClO£ + H2”ü
£Ø2£©¢Ł×ó ¢Ś Cl2 O2 + 4e- + 2H2O = 4OH- C ¢Ū ŃōĄė×Ó½»»»Ä¤
£Ø3£©bcd
½āĪöŹŌĢā·ÖĪö£ŗ¢ĒĻņĀČĖ®ÖŠ¼ÓČėNaHCO3£¬,Ģ¼ĖįĒāÄĘÓėŃĪĖį·“Ó¦£¬ĀČĘųÓėĖ®µÄ·“Ó¦ÕżĻņ½ųŠŠ£¬æÉŅŌŌö“óĀČĖ®ÖŠ“ĪĀČĖįµÄÅØ¶Č£¬ÕżČ·£»ĖÄÖÖČÜŅŗÖŠ£¬Ė®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒĖ®½ā³Ģ¶Č×ī“óµÄ£¬Ņ²¾ĶŹĒ¼īŠŌ×īĒæµÄ£¬Ó¦ĪŖĢ¼ĖįÄĘ£¬¶ų²»ŹĒNaClO£¬“ķĪó£»³£ĪĀĻĀ£¬ĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄH2SO3”¢H2CO3”¢HClO£¬pH×ī“óµÄŹĒÓ¦øĆŹĒĖįŠŌ×īČõµÄ£¬Ņ²¾ĶŹĒĖÄÖÖŃĪÖŠ¼īŠŌ×īĒæµÄŃĪĖł¶ŌÓ¦µÄÄĒÖÖĖį£¬¼“Ģ¼Ėį¶ų²»ŹĒŃĒĮņĖį£¬“ķĪó£»NaHSO3ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖc£ØNa+£©>c£ØHSO3-£©> c£ØH+£© >c£ØSO32-£©>c£ØOH-£©£¬“ķĪó”£
æ¼µć£ŗæ¼²éµē½āÖŹČÜŅŗµÄÓŠ¹ŲÖŖŹ¶”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
pCĄąĖĘpH,ŹĒÖø¼«Ļ”ČÜŅŗÖŠ,ČÜÖŹĪļÖŹµÄĮæÅØ¶ČµÄ³£ÓƶŌŹżøŗÖµ”£ČēijČÜŅŗČÜÖŹµÄÅضČĪŖ1”Į10-3mol”¤L-1,ŌņøĆČÜŅŗÖŠČÜÖŹµÄpC=-lg(1”Į10-3)=3”£ĻĀĶ¼ĪŖ,H2CO3ŌŚ¼ÓČėĒæĖį»ņĒæ¼īČÜŅŗŗó,Ę½ŗāŹ±ČÜŅŗÖŠČżÖֳɷֵÄpC”ŖpHĶ¼”£Ēė»Ų“šĻĀĮŠĪŹĢā: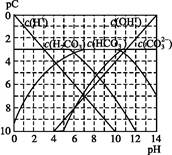
(1)ŌŚČĖĢåŃŖŅŗÖŠ,HC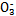 ÄÜĘšµ½Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35~7.45µÄ×÷ÓĆ”£¢ŁĒėÓƵē½āÖŹČÜŅŗÖŠµÄĘ½ŗā½āŹĶ:””””””””””””””””””””””””””””””(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
ÄÜĘšµ½Ź¹ČĖĢåŃŖŅŗpH±£³ÖŌŚ7.35~7.45µÄ×÷ÓĆ”£¢ŁĒėÓƵē½āÖŹČÜŅŗÖŠµÄĘ½ŗā½āŹĶ:””””””””””””””””””””””””””””””(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
¢ŚÕż³£ČĖĢåŃŖŅŗÖŠ,HC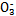 µÄĖ®½ā³Ģ¶Č””””””””µēĄė³Ģ¶Č(Ģī”°<”±”°>”±»ņ”°=”±)”£
µÄĖ®½ā³Ģ¶Č””””””””µēĄė³Ģ¶Č(Ģī”°<”±”°>”±»ņ”°=”±)”£
¢ŪpH=7.00µÄŃŖŅŗÖŠ,c(H2CO3)””””””””c(HC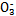 )(Ģī”°<”±”°>”±»ņ”°=”±)”£
)(Ģī”°<”±”°>”±»ņ”°=”±)”£
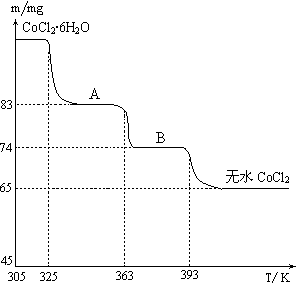
(2)H2CO3Ņ»¼¶µēĄėĘ½ŗā³£ŹżµÄŹżÖµ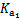 ”Ö”””””””””£
”Ö”””””””””£
(3)ijĶ¬Ń§ČĻĪŖøĆČÜŅŗÖŠNa2CO3µÄĖ®½āŹĒĪ¢ČõµÄ,·¢ÉśĖ®½āµÄC ²»³¬¹żĘä×ÜĮæµÄ10%”£ĒėÄćÉč¼Ę¼ņµ„ŹµŃéÖ¤Ć÷øĆĶ¬Ń§µÄ¹ŪµćŹĒ·ńÕżČ·
²»³¬¹żĘä×ÜĮæµÄ10%”£ĒėÄćÉč¼Ę¼ņµ„ŹµŃéÖ¤Ć÷øĆĶ¬Ń§µÄ¹ŪµćŹĒ·ńÕżČ·
”””£
(4)ŅŃÖŖijĪĀ¶ČĻĀLi2CO3µÄKspĪŖ1.68”Į10-3,½«ŹŹĮæLi2CO3¹ĢĢåČÜÓŚ100 mLĖ®ÖŠÖĮøÕŗƱ„ŗĶ,±„ŗĶLi2CO3ČÜŅŗÖŠc(Li+)="0.15" mol”¤L-1”¢c(C )="0.075" mol”¤L-1”£Čōt1Ź±æĢŌŚÉĻŹöĢåĻµÖŠ¼ÓČė100 mL 0.125 mol”¤L-1 Na2CO3ČÜŅŗ,ĮŠŹ½¼ĘĖćĖµĆ÷ŹĒ·ńÓŠ³Įµķ²śÉś”£
)="0.075" mol”¤L-1”£Čōt1Ź±æĢŌŚÉĻŹöĢåĻµÖŠ¼ÓČė100 mL 0.125 mol”¤L-1 Na2CO3ČÜŅŗ,ĮŠŹ½¼ĘĖćĖµĆ÷ŹĒ·ńÓŠ³Įµķ²śÉś”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
×ī½üĪķö²ĢģĘųĖĮÅ°ĪŅ¹ś“ó²æ·ÖµŲĒų”£ĘäÖŠSO2ŹĒŌģ³ÉæÕĘųµÄĪŪČ¾µÄÖ÷ŅŖŌŅņ£¬ĄūÓĆÄĘ¼īŃ»··ØæɳżČ„SO2”£
£Ø1£©ÄĘ¼īŃ»··ØÖŠ£¬ĪüŹÕŅŗĪŖNa2SO3ČÜŅŗ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
£Ø2£©ŅŃÖŖH2SO3µÄµēĄė³£ŹżĪŖK1£½1.54”Į10£2£¬K2£½1.024”Į10£7£»H2CO3µÄµēĄė³£ŹżĪŖK1£½4.30”Į10£7£¬K2£½5.60”Į10£11£¬ŌņĻĀĮŠĪ¢Į£æÉŅŌ“óĮæ¹²“ęµÄŹĒ______£ØĢīŠņŗÅ£©”£
A.CO32£ HSO3£ B. HCO3£ HSO3£ C. SO32£ HCO3£ D. H2SO3 HCO3£
£Ø3£©ĪüŹÕŅŗĪüŹÕSO2µÄ¹ż³ĢÖŠ£¬pHĖęn(SO32£):n(HSO3£)±ä»Æ¹ŲĻµČēĻĀ±ķ£ŗ
| n(SO32£):n(HSO3£) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
25”ꏱ£¬µēĄėĘ½ŗā³£Źż£ŗ
| »ÆѧŹ½ | CH3COOH | H2CO3 | HClO | H2C4H4O6(¾ĘŹÆĖį) | H2SO3 |
| µēĄėĘ½ŗā³£Źż | 2.0”Į10-5 | K1=4.3”Į10-7 K2=5.6”Į10-11 | 3.0”Į10-8 | K1=9.1”Į10-4 K2=4.3”Į10-5 | K1=1.3”Į10-2 K2=6.3”Į10-8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Čō·Ö±š½«pH=2µÄŃĪĖįŗĶ“×ĖįĻ”ŹĶ100±¶£¬ŌņĻ”ŹĶŗóČÜŅŗµÄpH£ŗŃĪĖį “×Ėį£ØĢī”°£¾”±”¢”°£½”±»ņ”°£¼”±£©”£
£Ø2£©½«100mL 0.1mol?L-1µÄCH3COOHČÜŅŗÓė50mL 0.2mol?L-1µÄNaOHČÜŅŗ»ģŗĻ£¬ĖłµĆČÜŅŗ³Ź ŠŌ£¬ŌŅņŹĒ £ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©”£
£Ø3£©0.1mol”¤mol-1µÄ°±Ė®ČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗāNH3+H2O  NH3”¤H2O
NH3”¤H2O NH4++OH££¬ŌŚ“ĖĘ½ŗāĢåĻµÖŠøıäĢõ¼ž£Ø¼ūĻĀ±ķ£©£¬ĒėĶź³É±ķÖŠæÕøń£ŗ
NH4++OH££¬ŌŚ“ĖĘ½ŗāĢåĻµÖŠøıäĢõ¼ž£Ø¼ūĻĀ±ķ£©£¬ĒėĶź³É±ķÖŠæÕøń£ŗ
| | Ģõ¼žµÄ±ä»Æ | ĶØ°±Ęų | ¼ÓĖ® | ¼ÓNH4Cl(s) |
| ¢Ł | µēĄėĘ½ŗāŅĘ¶ÆµÄ·½Ļņ | | | |
| ¢Ś | c(OH£)µÄ±ä»Æ | | | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ņ»ÖÖŗ¬ĀĮ”¢ļ®”¢īܵĊĀŠĶµē×Ó²ÄĮĻ£¬Éś²śÖŠ²śÉśµÄ·ĻĮĻŹżĮææɹŪ£¬·ĻĮĻÖŠµÄĀĮŅŌ½šŹōĀĮ²µÄŠĪŹ½“ęŌŚ£»īÜŅŌCo2O3”¤CoOµÄŠĪŹ½“ęŌŚ£¬Īüø½ŌŚĀĮ²µÄµ„Ćę»ņĖ«Ćę£»ļ®»ģŌÓÓŚĘäÖŠ”£
“Ó·ĻĮĻÖŠ»ŲŹÕŃõ»ÆīÜ£ØCoO£©µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ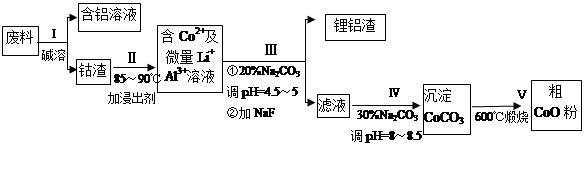
£Ø1£©¹ż³ĢIÖŠ²ÉÓĆNaOHČÜŅŗČܳö·ĻĮĻÖŠµÄAl£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø2£©¹ż³Ģ¢óµĆµ½ļ®ĀĮŌüµÄÖ÷ŅŖ³É·ÖŹĒLiFŗĶAl(OH)3£¬Ģ¼ĖįÄĘČÜŅŗŌŚ²śÉśAl(OH)3Ź±ĘšÖŲŅŖ×÷ÓĆ£¬ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½________ ____________”£
£Ø3£©Ģ¼ĖįÄĘČÜŅŗŌŚ¹ż³ĢIIIŗĶIVÖŠĖłĘš×÷ÓĆÓŠĖł²»Ķ¬£¬ĒėŠ“³öŌŚ¹ż³ĢIVÖŠĘšµÄ×÷ÓĆŹĒ ”£
£Ø4£©ŌŚNa2CO3ČÜŅŗÖŠ“ęŌŚ¶ąÖÖĮ£×Ó£¬ĻĀĮŠø÷Į£×ÓÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ___ ___£ØĢīŠņŗÅ£©”£
| A£®c(Na+) = 2c(CO32-) |
| B£®c(Na+) > c(HCO3-) > c(CO32-) |
| C£®c(OH-) > c(HCO3-) > c(H+) |
| D£®c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
A”¢B”¢C”¢ D”¢ EĪåÖÖČÜŅŗ·Ö±šŹĒNaOH”¢NH3·H2O”¢CH3COOH ”¢HCl”¢NH4HSO4ÖŠµÄŅ»ÖÖ”£³£ĪĀĻĀ½ųŠŠĻĀĮŠŹµŃé£ŗ
¢Ł½«1 L pH=3µÄAČÜŅŗ·Ö±šÓė0£®001mol·L£1 xL BČÜŅŗ”¢0£®001mol·L£1 yL DČÜŅŗ³ä·Ö·“Ó¦ÖĮÖŠŠŌ£¬x”¢y“󊔹ŲĻµĪŖ£ŗ y£¼x£»
¢ŚÅØ¶Č¾łĪŖ0£®1mol·L£1AŗĶEČÜŅŗ£¬pH£ŗA£¼E£»
¢ŪÅØ¶Č¾łĪŖ0£®1mol·L£1CÓėDČÜŅŗµČĢå»ż»ģŗĻ£¬ČÜŅŗ³ŹĖįŠŌ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©DŹĒ ČÜŅŗ£¬ÅŠ¶ĻĄķÓÉŹĒ ”£
£Ø2£©ÓĆĖ®Ļ”ŹĶ0£®1 mol·L£1BŹ±£¬ČÜŅŗÖŠĖę×ÅĖ®ĮæµÄŌö¼Ó¶ų¼õŠ”µÄŹĒ £ØĢīŠ“ŠņŗÅ£©
¢Ł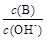 ¢Ś
¢Ś 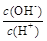 ¢Ū c£ØH+£©ŗĶc£ØOH-£©µÄ³Ė»ż ¢Ü OH£µÄĪļÖŹµÄĮæ
¢Ū c£ØH+£©ŗĶc£ØOH-£©µÄ³Ė»ż ¢Ü OH£µÄĪļÖŹµÄĮæ
£Ø3£©OH£ÅضČĻąĶ¬µÄµČĢå»żµÄĮ½·ŻČÜŅŗAŗĶE£¬·Ö±šÓėŠæ·Ū·“Ó¦£¬Čō×īŗó½öÓŠŅ»·ŻČÜŅŗÖŠ“ęŌŚŠæ·Ū£¬ĒŅ·Å³öĒāĘųµÄÖŹĮæĻąĶ¬£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________£ØĢīŠ“ŠņŗÅ£©
¢Ł·“Ó¦ĖłŠčŅŖµÄŹ±¼äE>A
¢ŚæŖŹ¼·“Ó¦Ź±µÄĖŁĀŹA>E
¢Ū²Ī¼Ó·“Ó¦µÄŠæ·ŪĪļÖŹµÄĮæA=E
¢Ü·“Ó¦¹ż³ĢµÄĘ½¾łĖŁĀŹ E>A
¢ŻAČÜŅŗĄļÓŠŠæ·ŪŹ£Óą
¢ŽEČÜŅŗĄļÓŠŠæ·ŪŹ£Óą
£Ø4£©½«µČĢå»ż”¢µČĪļÖŹµÄĮæÅضČBŗĶC»ģŗĻŗóČÜŅŗ£¬ÉżøßĪĀ¶Č£ØČÜÖŹ²»»į·Ö½ā£©ČÜŅŗpHĖęĪĀ¶Č±ä»ÆČēĶ¼ÖŠµÄ_________ĒśĻߣØĢīŠ“ŠņŗÅ£© ”£ŹŅĪĀĻĀ£¬Ļņ0£®01mol·L£1 CČÜŅŗÖŠµĪ¼Ó0£®01mol·L£1 DČÜŅŗÖĮÖŠŠŌ£¬µĆµ½µÄČÜŅŗÖŠĖłÓŠĄė×ÓµÄĪļÖŹµÄ ĮæÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ ”£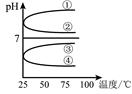
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ņ»¶ØĪĀ¶ČĻĀ£¬±ł“×Ėį¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠČÜŅŗµÄµ¼µēÄÜĮ¦±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£¬Ēė»Ų“š£ŗ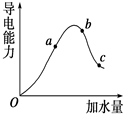
£Ø1£© ”°O”±µćĪŖŹ²Ć“²»µ¼µē________.
£Ø2£©a£¬b£¬cČżµćµÄpHÓÉŠ”µ½“óµÄĖ³ŠņŹĒ____________.
£Ø3£© a”¢b”¢cČżµćÖŠµēĄė³Ģ¶Č×ī“óµÄŹĒ
µēĄėĘ½ŗā³£ŹżKa”¢Kb”¢KcµÄ“󊔹ŲĻµĪŖ________.
£Ø4£©ČōŹ¹cµćČÜŅŗÖŠµÄc(CH3COO-)Ōö“ó£¬æÉŅŌ²ÉČ”ĻĀĮŠ“ėŹ©ÖŠµÄ ________(ĢīŠņŗÅ).
A¼ÓČČ£»B¼ÓŗÜĻ”µÄNaOHČÜŅŗ£»C¼ÓNaOH¹ĢĢ壻D¼ÓĖ®£»E¼Ó¹ĢĢåCH3COONa£»F¼ÓČėŠæĮ£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Šķ¶ąĮņµÄŗ¬ŃõĖįŃĪŌŚŅ½Ņ©”¢»Æ¹¤µČ·½ĆęÓŠ×ÅÖŲŅŖµÄÓĆĶ¾”£
£Ø1£©)ÖŲ¾§ŹÆ£ØBaS04)³£×÷Īø³¦µĄŌģÓ°¼Į”£
ŅŃÖŖ£ŗ³£ĪĀĻĀ£¬Ksp(BaSO4)=1.1”Į10-10£¬ĻņBaSO4Šü×ĒŅŗÖŠ¼ÓČėĮņĖį£¬µ±ČÜŅŗµÄpH=2Ź±£¬ ČÜŅŗÖŠ c(Ba2+)= ”£
£Ø2£©ĮņĖįŃĒĢśļ§¾§Ģå[(NH4)2Fe(SO4)2”¤6H20]³£×÷·ÖĪö¼Į”£
¢Ł¼ģŃ龧ĢåÖŠŗ¬ÓŠNH4+µÄ·½·ØĪŖ_______”£
¢ŚµČĪļÖŹµÄĮæÅØ¶ČµÄĖÄÖÖĻ”ČÜŅŗ£ŗ
a£®(NH4)2Fe(SO4)2 b£®NH4HSO4 c£®(NH4)2SO4 d£®(NH4)2SO3
ĘäÖŠC(NH4+)Óɓ󵽊”µÄĖ³ŠņĪŖ £ØĢīŃ”Ļī×ÖÄø£©”£
£Ø3£©¹ż¶žĮņĖį¼Ų£ØK2S2O8)³£×÷ĒæŃõ»Æ¼Į£¬Na2S2O3³£×÷»¹Ō¼Į”£
¢ŁK2S2O8ČÜŅŗÓėĖįŠŌMnSO4ČÜŅŗ»ģŗĻ,ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬æÉŅŌ¹Ū²ģµ½ČÜŅŗ±äĪŖ×ĻÉ«£¬ øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ
¢ŚÓĆ²¬×÷µē¼«£¬µē½āH2SO4ŗĶK2SO4µÄ»ģŗĻČÜŅŗæÉŅŌÖʱøK2S2O8£¬ĘäŃō¼«µÄµē¼«·“Ó¦Ź½ĪŖ_____ __µē½ā¹ż³ĢÖŠŅõ¼«ø½½üČÜŅŗµÄpH½«______ (Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)
¢Ū²śĘ·ÖŠK2S2O8µÄŗ¬ĮææÉÓƵāĮæ·Ø²ā¶Ø”£²Ł×÷²½ÖčĪŖ£ŗ³ĘČ”0.3g²śĘ·ÓŚµāĮæĘæÖŠ£¬¼Ó50 mLĖ®Čܽā£»¼ÓČė4.000 g KI¹ĢĢå(ÉŌ¹żĮ棩£¬Õńµ“Ź¹Ęä³ä·Ö·“Ó¦£»¼ÓČėŹŹĮæ“×ĖįČÜŅŗĖį»Æ£¬ŅŌ______ĪŖÖøŹ¾¼Į£¬ÓĆ0.1000 mol”¤L-1 Na2S2O3±ź×¼ŅŗµĪ¶ØÖĮÖÕµć£ØŅŃÖŖ£ŗI2£«2S2O32£=2I££«S4O62££©”£ÖŲø“2“Ī£¬²āµĆĘ½¾łĻūŗıź×¼Ņŗ21.00mL”£øĆ²śĘ·ÖŠK2S2O8µÄÖŹĮæ·ÖŹżĪŖ(ŌÓÖŹ²»²Ī¼Ó·“Ó¦) (ĮŠŹ½²¢¼ĘĖć£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com