
 2SO3(g) ¦¤H=" ØC196.6" kJ”¤mol-1
2SO3(g) ¦¤H=" ØC196.6" kJ”¤mol-1 2NO2(g) ¦¤H=" ØC113.0" kJ”¤mol-1
2NO2(g) ¦¤H=" ØC113.0" kJ”¤mol-1 SO3(g)+NO(g)µÄ¦¤H= kJ”¤mol-1”£
SO3(g)+NO(g)µÄ¦¤H= kJ”¤mol-1”£
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CO2(g
CO2(g ) + H2(g)
) + H2(g)  CO(g) + H2O(g),ĘäĘ½ŗā³£Źż£ĖŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ£ŗ
CO(g) + H2O(g),ĘäĘ½ŗā³£Źż£ĖŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ£ŗ| t”ę | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 N2O4 (g) ”÷H=" -92.4kJ/mol " “ļµ½»ÆŃ§Ę½ŗāדĢ¬ĒŅĘäĖüĢõ¼ž²»±äŹ±£¬
N2O4 (g) ”÷H=" -92.4kJ/mol " “ļµ½»ÆŃ§Ę½ŗāדĢ¬ĒŅĘäĖüĢõ¼ž²»±äŹ±£¬²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 C(g) “ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖ40£„”£ŹŌ»Ų“šÓŠ¹ŲĪŹĢā£ŗ
C(g) “ļµ½Ę½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖ40£„”£ŹŌ»Ų“šÓŠ¹ŲĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®3O2(g) 2O3(g)(Õż·“Ó¦ĪŖĪüČČ·“Ó¦) 2O3(g)(Õż·“Ó¦ĪŖĪüČČ·“Ó¦) |
B£®2NO2(g) N2O4(g) (Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦) N2O4(g) (Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦) |
C£®NH4HCO3(s) NH3(g)+CO2(g)+H2O(g) (Õż·“Ó¦ĪŖĪüČČ·“Ó¦ NH3(g)+CO2(g)+H2O(g) (Õż·“Ó¦ĪŖĪüČČ·“Ó¦ ) ) |
D£®H2(g)+I2(g) 2HI(g) (Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦) 2HI(g) (Õż·“Ó¦ĪŖ·ÅČČ·“Ó¦) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CO2+H2£¬“ļĘ½ŗāŗó²āµĆCO2ĪŖ0.75 molŌŁĶØČė6 molĖ®ÕōĘų£¬“ļµ½ŠĀµÄĘ½ŗāŗó£¬CO2ŗĶH2µÄĪļÖŹµÄĮæÖ®ŗĶæÉÄÜĪŖ
CO2+H2£¬“ļĘ½ŗāŗó²āµĆCO2ĪŖ0.75 molŌŁĶØČė6 molĖ®ÕōĘų£¬“ļµ½ŠĀµÄĘ½ŗāŗó£¬CO2ŗĶH2µÄĪļÖŹµÄĮæÖ®ŗĶæÉÄÜĪŖ| A£®1.2 mol | B£®1.5 mol | C£®1.8 mol | D£®2.5 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŠĀÖʵÄĀČĖ®ŌŚ¹āÕÕĢõ¼žĻĀŃÕÉ«±äĒ³ |
| B£®¼ÓČė“߻ƼĮÓŠĄūÓŚ°±µÄŃõ»Æ·“Ó¦ |
| C£®ŹµŃéŹŅÖŠ³£ÓĆÅű„ŗĶŹ³ŃĪĖ®µÄ·½·ØŹÕ¼ÆĀČĘų |
| D£®¹¤ŅµÉĻÉś²śĮņĖįµÄ¹ż³ĢÖŠŹ¹ÓĆ¹żĮæµÄæÕĘųŅŌĢįø߶žŃõ»ÆĮņµÄĄūÓĆĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g)+D(s)£¬
2C(g)+D(s)£¬²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 nC£Øg£©£Ø”÷H<0£©ŌŚ²»Ķ¬Ģõ¼žĻĀ·“Ó¦»ģŗĻĪļÖŠCµÄĢå»ż·ÖŹżÓė·“Ó¦¹ż³ĢĖłŠčŹ±¼äµÄ¹ŲĻµĒśĻß”£ŌņĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
nC£Øg£©£Ø”÷H<0£©ŌŚ²»Ķ¬Ģõ¼žĻĀ·“Ó¦»ģŗĻĪļÖŠCµÄĢå»ż·ÖŹżÓė·“Ó¦¹ż³ĢĖłŠčŹ±¼äµÄ¹ŲĻµĒśĻß”£ŌņĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ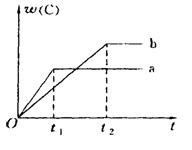
| A£®a±ķŹ¾ÓŠ“߻ƼĮ£¬b±ķŹ¾ĪŽ“߻ƼĮ |
| B£®ČōĘäĖūĢõ¼žĻąĶ¬£¬a±ČbµÄĪĀ¶ČµĶ |
| C£®·“Ó¦ÓÉÕż·“Ó¦æŖŹ¼ |
| D£®·“Ó¦ÓÉÄę·“Ó¦æŖŹ¼ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com