
����Ŀ����ѧ��һֱ�����ڶԻ�ѧ��Ӧ���еķ����Ⱥ����ʽ����о���Ѱ�Һ������۶�����н��͡�
I.Ϊ����������β����Ⱦ������NO��CO������ȣ�����ѧ�������������������װ�ϴ����������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��ij�¶��£������Ϊ1L���ܱ������г���NO��CO��0.1mol��ƽ��ʱNO��ת����Ϊ60%������÷�Ӧ��ƽ�ⳣ��K=______________���˷�Ӧ�������ܹ��Է����е�ԭ����_______________________��
N2(g)+2CO2(g)��ij�¶��£������Ϊ1L���ܱ������г���NO��CO��0.1mol��ƽ��ʱNO��ת����Ϊ60%������÷�Ӧ��ƽ�ⳣ��K=______________���˷�Ӧ�������ܹ��Է����е�ԭ����_______________________��
��.��ͼ�Ǹ������������Һ����ᷢ����Ӧ���й�ͼ����Һ���Ϊ500mL��
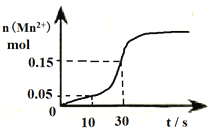
��1���÷�Ӧ��10-30s�Ļ�ѧ��Ӧ����v(Mn2+)=________________________��
��2����д���÷�Ӧ�����ӷ���ʽ____________________________________________________��
��3���۲�ͼ��˵����һ���¶��·�Ӧ������ʼ����Ȼ��ӿ��ԭ��______________________��
��. ���ܵ����FeS��ˮ��Һ�д������ܽ�ƽ����FeS(s)![]() Fe2+(aq) + S2��(aq),��һ���¶��£�Ksp=c(Fe2+)��c(S2��)=6.25��10-18���ڸ��¶��£������ᱥ����Һ�д���c2(H+)�� c(S2��)=1.0��10-22��������FeCl2Ͷ�������ᱥ����Һ�У���ʹ��Һ��c(Fe2+)=1.0 mol��L��1��Ӧ������Һ��c(H+)=_______��
Fe2+(aq) + S2��(aq),��һ���¶��£�Ksp=c(Fe2+)��c(S2��)=6.25��10-18���ڸ��¶��£������ᱥ����Һ�д���c2(H+)�� c(S2��)=1.0��10-22��������FeCl2Ͷ�������ᱥ����Һ�У���ʹ��Һ��c(Fe2+)=1.0 mol��L��1��Ӧ������Һ��c(H+)=_______��
IV.��������H2S�Ƿֲ�����ģ�H2S![]() H+ + HS�� K1=1.3��10-7��HS-
H+ + HS�� K1=1.3��10-7��HS-![]() H+ + S2�� K2=7.1��10-15��ʹ��Һ��c(S2��)Ũ������Ӧ��ȡ�Ĵ�ʩ��_____________��
H+ + S2�� K2=7.1��10-15��ʹ��Һ��c(S2��)Ũ������Ӧ��ȡ�Ĵ�ʩ��_____________��
A������NaOH B������CuSO4 C���ʵ������¶� D��ͨ�����SO2 E������Na2CO3 (H2CO3���볣��K1=4.4��10-7��K2=4.7��10-11)
���𰸡� K= 42.2L��mol��1�� ![]() L��mol��1 ��Ϊ�÷�ӦΪ���ȷ�Ӧ������Ϊ�÷�Ӧ��H <0�� v(Mn2+)= 0.01mol��(L��s)��1 2MnO4��+5H2C2O4+6H+��10CO2��+2Mn2++8H2O ���ɵ�Mn2+�Է�Ӧ�д����� c(H+)=4��10��3 mol�� L��1 AE
L��mol��1 ��Ϊ�÷�ӦΪ���ȷ�Ӧ������Ϊ�÷�Ӧ��H <0�� v(Mn2+)= 0.01mol��(L��s)��1 2MnO4��+5H2C2O4+6H+��10CO2��+2Mn2++8H2O ���ɵ�Mn2+�Է�Ӧ�д����� c(H+)=4��10��3 mol�� L��1 AE
��������I. ij�¶��£������Ϊ1L���ܱ������г���NO��CO��0.1mol��ƽ��ʱNO��ת����Ϊ60%����������ʽ���У�
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��ʼŨ�ȣ�mol/L�� 0.1 0.1 0 0
ת��Ũ�ȣ�mol/L�� 0.06 0.06 0.03 0.06
ƽ��Ũ�ȣ�mol/L�� 0.04 0.04 0.03 0.06
��÷�Ӧ��ƽ�ⳣ��K=![]() =42.2L��mol��1��
=42.2L��mol��1�� ![]() L��mol��1��2NO(g)+2CO(g)
L��mol��1��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)Ϊ�ؼ��ķ�Ӧ���˷�Ӧ�������ܹ��Է�������˵���÷�ӦΪ���ȷ�Ӧ�����÷�Ӧ����H <0���ʴ�Ϊ��42.2L��mol��1��
N2(g)+2CO2(g)Ϊ�ؼ��ķ�Ӧ���˷�Ӧ�������ܹ��Է�������˵���÷�ӦΪ���ȷ�Ӧ�����÷�Ӧ����H <0���ʴ�Ϊ��42.2L��mol��1�� ![]() L��mol��1����Ϊ�÷�ӦΪ���ȷ�Ӧ������Ϊ�÷�Ӧ��H <0����
L��mol��1����Ϊ�÷�ӦΪ���ȷ�Ӧ������Ϊ�÷�Ӧ��H <0����
II. ��. ��ͼ��֪��10sʱc(Mn2+)=0.05mol��0.5L=0.1mol/L��30sʱ c(Mn2+) = 0.15mol��0.5L=0.3mol/L���÷�Ӧ��10-30s�Ļ�ѧ��Ӧ����v(Mn2+) = ![]() =0.01mol��(L��s)��1���ʴ�Ϊ��0.01mol��(L��s)��1��
=0.01mol��(L��s)��1���ʴ�Ϊ��0.01mol��(L��s)��1��
��. �������������Һ����ᷢ����Ӧʱ��MnԪ�صĻ��ϼ۴�+7�۽��͵�+2����CԪ�صĻ��ϼ۴�+3�����ߵ�+4�������ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+��10CO2��+2Mn2++8H2O���ʴ�Ϊ��2MnO4��+5H2C2O4+6H+��10CO2��+2Mn2++8H2O��
��. ���ŷ�Ӧ�Ľ��У���Һ�����ɵ�Mn2+Խ��Խ�࣬Mn2+�Է�Ӧ�д�������ʹ��Ӧ���ʼӿ죬�ʴ�Ϊ�����ɵ�Mn2+�Է�Ӧ�д����ã�
III. ������FeCl2Ͷ�������ᱥ����Һ�У���ʹ��Һ��c(Fe2+)=1.0 mol��L��1������Һ��c(S2)=![]() =
=![]() mol/L=6.25��1018mol/L����c2(H+)�� c(S2��)=1.0��10-22����c(H+)=
mol/L=6.25��1018mol/L����c2(H+)�� c(S2��)=1.0��10-22����c(H+)=![]() mol/L=4��10��3 mol�� L��1���ʴ�Ϊ��4��10��3 mol�� L��1��
mol/L=4��10��3 mol�� L��1���ʴ�Ϊ��4��10��3 mol�� L��1��
IV. A������NaOH�����������ӣ�ʹH2S�ĵ���ƽ�������ƶ���c(S2��)��������A��ȷ��B������CuSO4��S2����Cu2+��Ӧ����CuS������c(S2��)��С����B����/span>C. ��������ʵĵ��������ȹ������ʵ������¶ȣ�ʹH2S�ĵ���ƽ�������ƶ���c(S2��)��С����C����D. ͨ�����SO2����H2S������Ӧ��2H2S��SO2=3S����2H2O��ʹH2S�ĵ���ƽ�������ƶ���c(S2��)��С����D����E. ��H2S��H2CO3�ĵ��볣����֪������Na2CO3��H2S������Ӧ��H2S��CO32��=HS����HCO3����ʹ��Һ�е�HS��Ũ�����ٽ�HS��![]() H+ + S2��������У�c(S2��)��������E��ȷ����ѡAE��
H+ + S2��������У�c(S2��)��������E��ȷ����ѡAE��


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������Լ�ԭ����ȫ��Ӧ����
ʵ����� | ʵ������ | ԭ�� | |
A | �����£���Ũ�Ⱦ�Ϊ0.01mol��L-1��BaCl2��CaCl2�����Һ�еμ�Na2SO4��Һ | ���ְ�ɫ���� | Ksp(BaSO4)< Ksp(CaSO4) |
B | ��ˮ����ͨ�����ȵ����� | ���۱�Ϊ��ɫ | ��������ˮ�ڸ����·�����Ӧ |
C | �����ˮ��IJ����м������Ƶ�������Һ | û�г����������� | ���������Ƶ�������Һ�����˷�Ӧ |
D | ��ͬ�¶��£�����ͬ��С�ƿ�ֱ�ӵ�ˮ�����ᡢ�Ҵ��� | �������������ʣ�����>ˮ>�Ҵ� | ���ֵ���ʵ���H+����������>ˮ>�Ҵ� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ�����Ũ�������������ȷ���ǣ� ��
A.¶���ڿ����У���������Һ����������
B.Ũ����������鷴Ӧ
C.�����¶�����������������
D.�����ʵ����Ũ����ֻ������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���1mol HNO3��2molH2SO4�Ļ��ϡ��Һ�У�����1.5molCu�����ȳ�ַ�Ӧ�������������ڱ�״���µ����ԼΪ��������
A.5.6L
B.11.2L
C.22.4L
D.44.8L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ҵ���˵���У�����ȷ���ǣ� ��
A.������Ϊ��OHB.����NaOH��Ӧ
C.��ʹ���Եĸ��������Һ��ɫD.������ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڶ��������������ʵ������У�����ȷ���ǣ� ��
A.������ˮB.����������������Ӧ������������
C.��ʹƷ����Һ��ɫD.����NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Ga)λ�����ڱ��ĵ������ڣ���Alͬ���壬��Ҫ����Ga3+��GaO2-����������ʽ�����㷺Ӧ���ڵ��ӹ�ҵ��
��1�������ۺ�Fe2O3�����ȷ�Ӧʵ�飬��Ҫ���Լ�����__________________��
a��KClO3 b. KCl c. MnO2 d. Mg
��2���뵼����ϵ�������Ga��NH3��һ�������·����û���Ӧ���ɡ��ù���ÿ����1molGaN(s)�ų�����15.4kJ���������ڱ��е����_____________��д���÷�Ӧ���Ȼ�ѧ����ʽ_________________��
��3����ҵ���õ�ⷨ�����ء�����ԭ����ͼ��ʾ����֪�������Ļ��Zn>Ga>Fe>Cu

�ٵ�⾫����һ��ʱ����γɵ���������Ҫ��______________
����֪����ʱ������Ӧ��GaO2-+3e-+2H2O=Ga+4OH- �������ĵ缫��Ӧ����ʽ��___________________________________��
�����÷���Ƥ��ȡ����(Fe2O3)�IJ�������ʾ��ͼ���£�

��4������I�¶Ȳ��ܹ��ߡ���Ϊ��_______________________________��
��5������II�з�����Ӧ4Fe(NO3)2��O2��(2n��4)H2O��2Fe2O3��nH2O��8HNO3�����ɵ������ֽ�����Ƥ�е���ת��ΪFe(NO3)2��
д�����߷�Ӧ�����ӷ���ʽ______________________________________��
��6���������������У�����������ɫ��ѧ��˼�����______________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ����
A. ��֪�����ȼ����Ϊ890.3 kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H����890.3 kJmol-1
B. ��֪ǿ���ǿ���ϡ��Һ��Ӧ���к���Ϊ57.3 kJmol-1����CH3COOH��OH����CH3COO����H2O ��H����57.3 kJmol-1
C. һ�������£���0.5mol N2��1.5mol H2�����ܱ������У���ַ�Ӧ����NH3(g)���ų�����19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)��3H2(g)![]() 2NH3(g) ��H����38.6 kJmol-1
2NH3(g) ��H����38.6 kJmol-1
D. ��֪1g N2H4(l)������H2O2(l)��Ӧ���ɵ�����ˮ�������ų�����20.05kJ�����Ȼ�ѧ����ʽ�ɱ�ʾΪ��N2H4(l)��2H2O2(l)��N2(g)��4H2O(g) ��H����641.6 kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�֪ʶ�ش���������
��1��25��ʱ��0.1 molL��1��һԪ��HA��Һ��c(H��)��1.0��10��4 molL��1����ش��������⣺��ʱ��Һ��pH��_______��HA��________�ᣨ�ǿ������������
��2������NaHCO3��NaHSO3��NaHSO4���ֳ�������ʽ�Σ������ڹ�ҵ�������ճ����������Ź㷺��Ӧ�á���ش��й����⣺
��25��ʱ��NaHCO3��ˮ��Һ��_____�ԣ���ᡱ�����
��25��ʱ�����ʵ���Ũ�Ⱦ�Ϊ0.01 molL��1��������ʽ����Һ��pH��С��_________��
��3����50ml 0.018molL��1��AgNO3��Һ�м���50m1 0.020molL��1����������AgCl��������֪���¶���Ksp(AgCl)��1.0��10��10��������Һ������仯����ȫ��������Һ��c(Ag+)��__molL��1��
��4��������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ�����ʲ����뷴Ӧ����
ʵ�鲽�裺ȷ��ȡ1g Na2C2O4������Ʒ�����Ƴ�100mL��Һ��ȡ��20.00mL����ƿ�С�������ƿ�м�������ϡH2SO4��Һ����0.016 molL��1���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL��
����֪��5H2C2O4��2KMnO4��3H2SO4��10CO2����2MnSO4��K2SO4��8H2O��
�ٸ��������ҺӦװ��_______�ζ����У������ʽ����ʽ������
�ڵζ����յ�ʱ��ʵ�������ǣ�__________________________________________��
�����в�������ʹ�������ƫ�ߵ���__________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ�����
D����ƿ�в�������ˮ
�ܼ�����Ʒ��Na2C2O4�Ĵ���______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com