
(15分)阿司匹林(乙酰水杨酸,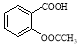 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:

请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)写出制备阿司匹林的化学方程式 。
(3)反应过程中,要控制温度在85 ℃~90 ℃,其原因是 ,
应采用的加热方法是 。用这种方法加热需要的玻璃仪器有 。
(4)抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(5)如何检验产品中是否混有水杨酸? 。
(1)防止乙酸酐水解
(2)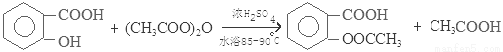
(3)防止乙酰水杨酸受热分解 水浴加热 温度计、酒精灯、烧杯
(4)关小水龙头,向布氏漏斗中加洗涤剂(冰水)至浸没沉淀物,使洗涤剂缓慢通过沉淀物。
(5)取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若发生显色反应则含水杨酸。
【解析】
试题分析:(1)制备阿司匹林时,要使用干燥的仪器是因为用水杨酸与醋酸酐反应再来制取,而醋酸酐与水会发生反应产生乙酸。所以为防止乙酸酐水解,仪器要干燥。(2)制备阿司匹林的化学方程式是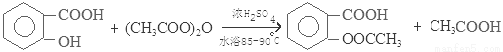
(3)反应过程中,要控制温度在85 ℃~90 ℃,因为乙酰水杨酸受热易分解,为防止其水解,温度要控制在其分解的温度范围内。由于温度低于100 ℃,所以一般采用水浴加热的方式。用这种方法加热需要的玻璃仪器有温度计、酒精灯、烧杯。(4)抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是关小水龙头,向布氏漏斗中加洗涤剂(冰水)至浸没沉淀物,使洗涤剂缓慢通过沉淀物。待冰水流出后,再重复几次,直至洗净为止。(5)由于水杨酸的分子中含有酚羟基,遇FeCl3溶液会显紫色,而阿司匹林中无酚羟基,不能发生显色反应。所以检验产品中是否混有水杨酸的方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若发生显色反应则含水杨酸。
考点:考查阿司匹林的制取方法、实验操作、制取方程式的书写等知识。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:填空题
(6分)现有浓度为0.lmol/L的五种电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2④CH3COONa⑤NaOH
已知:
(1)上述五种溶液的pH由大到小的顺序为________。(填序号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________。(填序号)
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是_______:(填序号)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:填空题
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液;
(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。试判断:
固体混合物中肯定有________,肯定没有________,可能有________,对可能有的物质,可采用滤液中滴加________溶液方法来检验。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
用坩埚钳夹住一小块刚用盐酸处理过的铝箱,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验中有关问题的解释不正确的是
A.铝箔熔化,失去金属光泽 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝高 D.氧化铝与盐酸不反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:推断题
(15分)铜是过渡金属元素,可以形成多种化合物。
(1)CuCl的盐酸溶液能够与CO发生反应:CuCl+CO+H2O=Cu(CO)Cl·H2O
①电负性:C ______O(填“>”或“=”或“<”)。②CO常温下为气体,固态时属于 晶体。
(2)Cu+与NH3形成的配合物可表示成[Cu(NH3)n]+,该配合物中,Cu+的4s轨道及4p通过sp杂化接受NH3提供的电子对。 [Cu(NH3) n]+ 中Cu+ 与n个氮原子的空间结构呈 型,n= 。
(3)CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
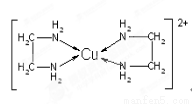
请回答下列问题:
①该配离子[Cu(En)2]2+中的中心原子的基态外围电子排布式为 。
②乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
③该配离子[Cu(En)2]2+中存在的作用力类型有 (填字母);
A配位键 B极性键 C离子键
D非极性键 E.氢键 F.金属键
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:选择题
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO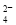 等离子,电极为惰性电极。下列叙述中正确的是
等离子,电极为惰性电极。下列叙述中正确的是
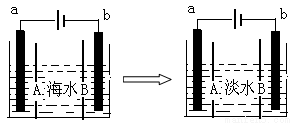
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为:4OH--4e- = O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
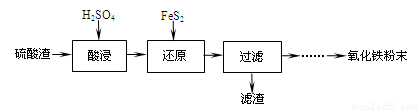
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
可用于鉴别以下三种化合物的一组试剂是
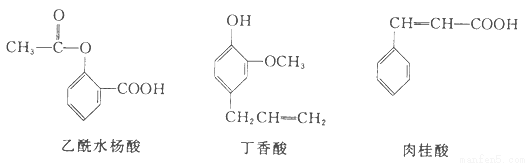
①银氨溶液②溴的四氯化碳溶液③氯化铁溶液④氢氧化钠溶液
A.①与② B.①与④ C.③与④ D.②与③
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省安阳市高三毕业班第二次模拟理综化学试卷(解析版) 题型:简答题
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。
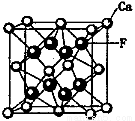
(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的C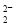 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C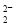 周围距离最近且相等的Ca2+数目为__________,C
周围距离最近且相等的Ca2+数目为__________,C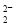 与O
与O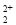 互为等电子体,O
互为等电子体,O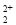 的电子式为____________。
的电子式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com